by spinedoctors | נוירופיזיולוגיה קלינית
אפיגנטי: קיים קשר גומלין בין חוויה חושית לבין תוכניות גנטיות מולדות המובילות לפיסול מעגלים נוירונים במהלך התפתחות המוח המוקדמת. עדויות אחרונות מראות כי הרגולציה הדינמית של ביטוי גנים באמצעות מנגנונים אפיגנטיים נמצאת בממשק שבין גירויים סביבתיים לבין פנוטיפים התנהגותיים מולקולריים, תאיים ומורכבים שנרכשו בתקופות של גמישות התפתחותית. הבנת מנגנונים אלה עשויה לתת תובנה להיווצרות תקופות קריטיות ולספק אסטרטגיות חדשות להגברת הפלסטיות ושינוי מסתגל בבגרות.
מבוא
במהלך הפיתוח המוקדם, מעגלים נוירונים נוצרים קשרים בין נוירונים לעבור שיפוץ כפי שהם מפתחים תכונות פונקציונליות למבוגרים שלהם בתגובה לסביבה שמסביב. המוח הבוגר מאבד את הפלסטיות יוצאת הדופן. ממצאים אחרונים תומכים תפקיד מפתח של גורמים אפיגנטיים בתיווך השפעות החוויה החושית על ביטוי גנים ספציפי לאתר, שידור סינפטי ופנוטיפים התנהגותיים. כאן אנו בודקים עדויות האחרונות המשפיעות על מנגנונים אפיגנטיים מרובים בשינויים התלויים בהתנסות במהלך ההתפתחות ודנים בתפקידם בביטוי נקודה קריטית במוח המתפתח והבוגרים.
אפיגנטיקה: מנגנונים מולקולריים של ויסות גנים
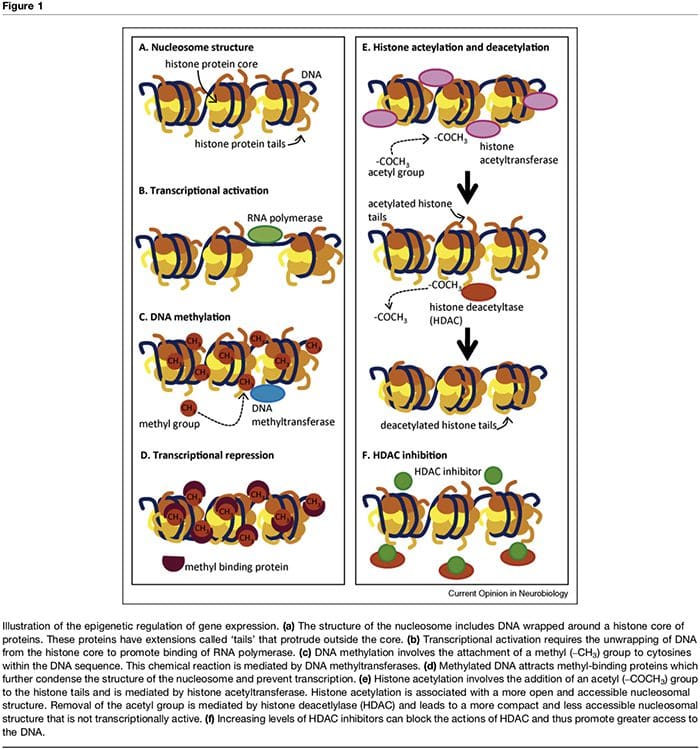
המונח "אפיגנטי" מתייחס לשינויים בכרומטין שמשנים את ביטוי הגנים מבלי להשפיע על רצף ה-DNA. הגורמים התורמים לוויסות האפיגנטי של פעילות שעתוק הם רבים וכוללים מיקרו-RNA [1], מתילציה של DNA [2,3] ושינויים לאחר תרגום של היסטונים נוקלאוזומליים [2,4]. מתילציה של DNA מתייחסת לשינוי כימי ל-DNA לפיו ציטוזין הופך ל-5-מתילציטוזין עם תוצאה של נגישות מופחתת של ה-DNA לגורמי שעתוק (איור 1a�d). שינויים אלה יכולים להיות יציבים ותורשתיים ולספק מנגנון קריטי בהתמיינות סלולרית [3]. תהליך המתילציה תלוי בנוכחותם של תורמי מתיל (המסופקים על ידי חומרים מזינים כגון חומצה פולית, מתיונין וכולין) ומתילטרנספראזות המתווך תחזוקה (כלומר DNMT1) או מתילציה של DNA דה נובו (כלומר DNMT3). דיכוי שעתוק הקשור עם מתילציה של DNA מתקיים עוד יותר באמצעות חלבונים קושרי מתיל כגון MeCP2 [5]. שליטה אפיגנטית של ביטוי גנים מתווכת גם באמצעות שינויים פוסט-תרגום מרובים של חלבוני היסטון, כולל מתילציה, אצטילציה ו-ubiquination, שיכולים לשנות את הנגישות של ה-DNA ואת צפיפות מבנה הכרומטין (איור 1e,f). בפרט, אצטילציה של היסטון קשורה לפעילות תעתיק מוגברת ואילו דה-אצטילציה של היסטון קשורה לדיכוי תעתיק. מצב האצטילציה של חלבונים נוקלאוזומליים אלה נשלט על ידי נוכחות של היסטון אצטילטרנספראזות (HATs), היסטון דאצטילאזות (HDACs), אשר מגויסים על ידי חלבונים קושרים מתיל, ועל ידי מעכבי HDAC, אשר למעשה מגבירים את ביטוי הגנים באמצעות הסטה של היסטונים לאצטיל. מצב [2,6]. התזמון ומידת ביטוי הגנים נשלטים באמצעות מנגנונים מורכבים אלה, ובכך מספקים קשר בין גנוטיפים בודדים לפנוטיפים מרובים.
גורמים אפיגנטיים והשפעת חוויות מוקדמות
בהתפתחות יונקים, תקופות טרום לידתי ואחרי הלידה מאופיינות בשינויים מהירים בארגון העצבתי, ובכך מספקים חלון הזדמנויות קריטי, שבמהלכו חוויות סביבתיות יכולות להוביל להשפעות ארוכות טווח על המוח וההתנהגות. ישנן ראיות גוברות לתפקידם של גורמים אפיגנטיים בתיווך הקשר בין חוויות אלו לבין תוצאות ארוכות טווח. מילר ו Bale [7] הוכיחו לאחרונה מתילציה דנ"א ירד של promotor Corticotrophin- שחרור גורם (CRF) promotor ו מתילציה מוגברת של קולטן glucocorticoid (GR) אקסון 17 באזור promotor ברקמה היפותלמית של עכברים זכרים בוגרים שנולדו לנקבות הדגיש gestationally . שינויים אפיגנטיים אלה קשורים בחשיפה ללחץ במהלך השלבים המוקדמים של התפתחות טרום לידתי ועשויים לכלול dysregulation של ביטוי גנים שליה. ה תזונתי הסביבה במהלך התפתחות העובר הוכיחה גם להשפיע על הצמיחה, חילוף החומרים ופיתוח המוח ויש ראיות הולך וגובר כי רמות התזונה של מתיל- תורמים יכול epigenetically לשנות ביטוי גנים בצאצא [8,9]. אצל חולדות, Lillycrop et al. [10] מדגימים ש- GR 110 ו- PPARa (פרוקסומיום המופעל על-ידי קולטן אלפא) מתילציה פרומוטורית גנטית מצטמצמת ברקמת הכבד של צאצאים שנולדו לסכרים מוגבלים בחלבון, ואילו המתילציה גדלה בצאצאים של סכרים שהדיאטה שלהם מתווספת עם תורמי מתיל [10,11 ]. השפעות אלה עשויות להיות קשורות לביטוי DNMT1, אשר גם הוא ירד עם הגבלת חלבון תזונתי [11]. תקנה תזונתיים טרום-לידתית של מתילציה דנ"א נצפתה גם ברקמת המוח הקשורה לרמות ביטוי DNMT1 [12], דבר המצביע על כך שבתקופה המהירה של חלוקת התא המתרחשת במהלך התפתחות העובר, לרמת התורמים המתיליים יכולה להיות השפעה משמעותית על פעילות התעתיק זה נשמר לבגרות.
 תפקידו של שינוי אפיגנטי בשמירה על ההשפעות של חוויה סביבתית הוכח גם בהקשר של אינטראקציות בין אם ותינוק לאחר לידה. שינויים אינדיבידואליים בטיפול האימהי במהלך התקופה המיידית שלאחר הלידה בחולדות קשורות לשינויים בפעילות ההיפותלמוס-יותרת המוח-אדרנל (HPA), מערכות נוירואנדוקריניות המעורבות ברבייה ופלסטיות ההיפוקמפוס [13]. ניתוחים של רמות של מתילציה פרומוטורית בתוך ההיפוקמפוס GR 17 וגנים ERa ההיפותלמוס בצאצאים של סכרי חולדות המספקים רמות גבוהות לעומת נמוכות של טיפול אימהי מצביעים על כך שרמות טיפול גבוהות קשורות לירידה במתילציה פרומוטורית ובכך מוגברת ביטוי גנים [14,15, 17]. למרות שהמסלול שדרכו השינויים האפיגנטיים הללו מתווכים עדיין לא ברור, יש עדויות לקשירה מוגברת של חלבון A הניתן להשראת גורם גדילה עצבי (NGFI-A) לקדם GR exon 15 בקרב צאצאים שמקבלים רמות גבוהות של טיפול בינקות [17] ומודלים במבחנה מצביעים על כך שוויסות-על של NGFI-A קשור לאצטילציה של היסטון, דה-מתילציה של DNA והפעלה של מקדם האקסון 16 GR [17]. הרלוונטיות של השפעות אלו בבני אדם הוכחה לאחרונה על ידי Oberlander et al. [1] בניתוח מצב המתילציה של מקדם GR באתרי קישור של NGFI-A בתאים חד-גרעיניים בדם טבורי של תינוקות שנחשפו למצב רוח אימהי מדוכא או חרד בשליש השלישי. דיכאון אימהי נמצא קשור עם מתילציה מעודדת GR 3F מוגברת בדגימות דם עובריות ודפוסי מתילציה אלו חזו תגובתיות של HPA בתינוקות בגיל 17 חודשים [1]. ניתוח של רקמת ההיפוקמפוס של קורבנות התאבדות עם היסטוריה של התעללות בילדות מצביע באופן דומה על ביטוי GR נמוך יותר ומתילציה מעודדת GR 18F גבוהה יותר הקשורים לשיבושים בסביבה המוקדמת ומאשר את הממצאים ממחקרי מכרסמים לפיהם קשירת NGFI-A דיפרנציאלית היא תוצאה תפקודית של אלה. השפעות אפיגנטיות [19]. עם זאת, ההשפעה של אינטראקציות בין אם סב-לידתיות אינה מוגבלת לוויסות GR כפי שהודגם על ידי Roth et al. [19] בחינת ההשפעות של התעללות לאחר לידה על מתילציה של גורם נוירוטרופי (BDNF) של צאצאים במוח [1]. בחולדות נמצאה עלייה במתילציה של אקסון IV של מקדם BDNF וכתוצאה מכך ירידה ב-BDNF mRNA בקורטקס הפרה-פרונטלי בקשר עם חשיפה לתקופות של טיפול אימהי פוגעני (גרירה, טיפול גס וכו'). כפי שהיה במקרה של ההשפעות של הבדלים אינדיבידואליים בטיפול האם, השפעות אלו הופיעו בינקות ונמשכו בבגרות. יתר על כן, השפעות אלו על מתילציה של BDNF exon IV מונצחות לדור ה-F20, דבר המצביע על תפקיד למנגנונים אפיגנטיים בהשפעות חוצות-דוריות [XNUMX].
תפקידו של שינוי אפיגנטי בשמירה על ההשפעות של חוויה סביבתית הוכח גם בהקשר של אינטראקציות בין אם ותינוק לאחר לידה. שינויים אינדיבידואליים בטיפול האימהי במהלך התקופה המיידית שלאחר הלידה בחולדות קשורות לשינויים בפעילות ההיפותלמוס-יותרת המוח-אדרנל (HPA), מערכות נוירואנדוקריניות המעורבות ברבייה ופלסטיות ההיפוקמפוס [13]. ניתוחים של רמות של מתילציה פרומוטורית בתוך ההיפוקמפוס GR 17 וגנים ERa ההיפותלמוס בצאצאים של סכרי חולדות המספקים רמות גבוהות לעומת נמוכות של טיפול אימהי מצביעים על כך שרמות טיפול גבוהות קשורות לירידה במתילציה פרומוטורית ובכך מוגברת ביטוי גנים [14,15, 17]. למרות שהמסלול שדרכו השינויים האפיגנטיים הללו מתווכים עדיין לא ברור, יש עדויות לקשירה מוגברת של חלבון A הניתן להשראת גורם גדילה עצבי (NGFI-A) לקדם GR exon 15 בקרב צאצאים שמקבלים רמות גבוהות של טיפול בינקות [17] ומודלים במבחנה מצביעים על כך שוויסות-על של NGFI-A קשור לאצטילציה של היסטון, דה-מתילציה של DNA והפעלה של מקדם האקסון 16 GR [17]. הרלוונטיות של השפעות אלו בבני אדם הוכחה לאחרונה על ידי Oberlander et al. [1] בניתוח מצב המתילציה של מקדם GR באתרי קישור של NGFI-A בתאים חד-גרעיניים בדם טבורי של תינוקות שנחשפו למצב רוח אימהי מדוכא או חרד בשליש השלישי. דיכאון אימהי נמצא קשור עם מתילציה מעודדת GR 3F מוגברת בדגימות דם עובריות ודפוסי מתילציה אלו חזו תגובתיות של HPA בתינוקות בגיל 17 חודשים [1]. ניתוח של רקמת ההיפוקמפוס של קורבנות התאבדות עם היסטוריה של התעללות בילדות מצביע באופן דומה על ביטוי GR נמוך יותר ומתילציה מעודדת GR 18F גבוהה יותר הקשורים לשיבושים בסביבה המוקדמת ומאשר את הממצאים ממחקרי מכרסמים לפיהם קשירת NGFI-A דיפרנציאלית היא תוצאה תפקודית של אלה. השפעות אפיגנטיות [19]. עם זאת, ההשפעה של אינטראקציות בין אם סב-לידתיות אינה מוגבלת לוויסות GR כפי שהודגם על ידי Roth et al. [19] בחינת ההשפעות של התעללות לאחר לידה על מתילציה של גורם נוירוטרופי (BDNF) של צאצאים במוח [1]. בחולדות נמצאה עלייה במתילציה של אקסון IV של מקדם BDNF וכתוצאה מכך ירידה ב-BDNF mRNA בקורטקס הפרה-פרונטלי בקשר עם חשיפה לתקופות של טיפול אימהי פוגעני (גרירה, טיפול גס וכו'). כפי שהיה במקרה של ההשפעות של הבדלים אינדיבידואליים בטיפול האם, השפעות אלו הופיעו בינקות ונמשכו בבגרות. יתר על כן, השפעות אלו על מתילציה של BDNF exon IV מונצחות לדור ה-F20, דבר המצביע על תפקיד למנגנונים אפיגנטיים בהשפעות חוצות-דוריות [XNUMX].
פיתוח לאורך החיים: אפיגנטיקה וחוויה פלסטית תלויה
החלק הקודם מדגיש את ההשפעות היציבות של חוויות החיים המוקדמות ואיך האירועים הללו מקודדים ברמה המולקולרית. גישה נוספת לחקר אפיגנטיקה ופיתוח נובעת ממחקרים של גמישות סינפטית במהלך הביטוי של פוטנטיציה לטווח ארוך (LTP) ואיחוד זיכרון. רמות גבוהות של טיפול אימהי וחשיפה להעשרה סביבתית לנוער הוכחו על מנת לשפר את יכולת הלמידה והזיכרון הקשורים בשיפור ה- LTP [21,22]. יתר על כן, עדויות האחרונות מראות כי EE מודולציה NMDAR / p38 / LTP איתות המסלולים בהיפוקמפוס ומשפר את ההקשר זיכרון פחד הקשר לאורך הדורות כגון צאצאים של אמהות מועשר כמו כן להראות LTP משופר גם כאשר צולבו בין לידות בלידה לא אמהות מועשר [23 ]. העשרה סביבתית קשורה עם אצטילציה היסטון מוגברת בהיפוקמפוס וזכרון מרחבי משופרת [24,25]. מיקוד פרמקולוגי של epigenome שימש להדגים את התפקיד של אצטילציה היסטון ו מתילציה דנ"א איחוד של זיכרון לטווח ארוך [26]. טיפול ב- zebularine (מעכב או DNA methyltransferases) הוכח לחסום היווצרות זיכרון ולהקטין את אצטילציית ההיסטון בעקבות התנסויות פחד קונבנציונאליות בחולדות בוגרים [27], בעוד שהטיפול ב- HDAC של מעכבי HDAC גורם ליצירה משופרת של זיכרונות פחד בהקשר [ 28]. יעד ה- HDAC הספציפי של מעכבים אלה עשוי להיות HDAC2 כמו הראיות האחרונות התברר ממחיש פלסטיות סינפטי ירד היווצרות זיכרון בעכברים יתר על המבט HDAC2 אבל לא HDAC1; עם אפקט הפוך ב HDAC2 עכברים לקוי [29]. מחקרים אלה ממחישים קשר אפשרי בין פעילות סינפטית לבין אצטילון היסטון / מתילציה של דנ"א בנוירונים בוגרים, דבר המצביע על כך שיש גמישות מתמשכת במערכות אפיגנטיות אלו מעבר לתקופות שלפני ואחרי הלידה.
מנגנון אפיגנטי והסדרת העברה סינפטית
שינויים תלויי פעילות בביטוי גנים בתוך מסלולים עצביים במהלך הפיתוח עשויים לשמש כמסלול קריטי המקשר בין חוויית הסביבה החיצונית לבין שינויים אפיגנטיים בתוך גרעין התא. במחקר שנערך לאחרונה, מונטג'יה ועמיתיו הוכיחו באלגנטיות כי טרנספורמציה סינפטית ספונטנית בנוירונים בהיפוקמפוס מוסדר על ידי שינויים במתילציה של דנ"א המתרחשים בתגובה לפעילות הסינפטית [30]. הטיפול במעכב DNMT מוביל לירידה משמעותית בתדירות של זרמים פוסט-סינפטיים מיניאטוריים (mEPSCs) וקצב של היתוך ספוגני שלפוחית סינפטית בקורלציה עם ירידה במקדמת BDNF ומתילציה והגברת הביטוי של BDNF. השפעה זו נחסמה עם עיכוב של פעילות סינפטי והפחתות mEPSCs נמנעו בהעדר MeCP2. תוצאות אלו מציעות בתוקף תפקיד מתילציה DNA / נתיבי MeCP2 בשליטה של הפונקציה הסינפטית. פעילות זרחנית תלויה של MeCP2 באמצעות Ca2 + -Calmodulindependent kinase II הוכחה כגורמת לניתוק דיפרנציאציה של MCP2 מגני מטרה ולהפחית את הדיכוי של התעתיק [31]. כתוצאה מכך, גנים כגון BDNF מוגברים בביטוי המוביל דפוסים דנדריטים נורמלי ופיתוח עמוד השדרה הדנדריטים [32]. ממצאים אלה מצביעים על מנגנון epigenetic שדרכו נוירונים יכולים לפקח על שינויים ברמת הפעילות ולהתאים את הפלט נוירוטרנסמיטר דרך ביטוי גנים שונה עם השלכות על רגישות הרשת ואת עידון מעגל. אי-תקינות במסלולים אלה של MCP2 עשויה להוביל למספר חריגות נוירו-התפתחותיות, כולל תסמונת Rett, אוטיזם אינפנטילי, פיגור שכלי וסכיזופרניה [33] ומיקוד ממוקד של MeCP2 באמיגדלה הוכח לאחרונה להפגין למידה וזיכרון ולהוביל לחרדה דמוית חרדה התנהגות בעכברים [34].
שליטה אפיגנטית על תקופת הפלסטיות הקריטית
למרות שמנגנונים אפיגנטיים בהחלט היו מעורבים בתיווך רמות הפלסטיות הגבוהות בהתפתחות המוקדמת, ניתן גם לראות את הפלסטיות הירידה והרגישות המתרחשת מאוחר יותר בהתפתחות מנקודת מבט אפיגנטית. מעגלים ניאוקורטיקליים רגישים ביותר למניפולציות של הסביבה החושית במהלך חלונות זמניים מוגבלים של התפתחות לאחר לידה הנקראים "תקופות קריטיות". לדוגמה, חוסר איזון בראייה הדו-עינית במהלך הילדות משפיע על התפיסה המובילה לאמבליופיה או לעין עצלה. חסך מונוקולרי (MD) משחזר את הפרדיגמה הקלאסית הזו של פלסטיות תלוית חוויה [35]. ההשפעה הפיזיולוגית הבולטת של MD היא שינוי בתגובת הנוירון החזותי של קליפת המוח לטובת העין הלא מקופחת; דוגמה לפלסטיות של דומיננטיות עיניים (OD). התקופה הקריטית שבמהלכה מתרחשת פלסטיות OD זו מוגדרת על ידי הפעלה ועיכוב לאחר מכן של מסלולים מולקולריים ספציפיים הכוללים מולקולות איתות כגון aCaMKII, calcineurin, PKA, ERK ו-CREB [36]. לאחרונה, Pizzorusso ועמיתיו זיהו עליות מהירות בזרחון תלוי-ERK של היסטונים הקשורים להפעלה של קליפת הראייה הצעירה והורדה התפתחותית של השפעה זו בעכברים מבוגרים [37]. בעכברים בוגרים, ניתן להחזיר את הפלסטיות המופחתת של ה-OD באמצעות טיפול במעכב HDAC trichostatin A (TSA). מנגנונים תאיים מרובים עשויים לתרום לביטוי פלסטיות תלוי חוויה [38]. עבודה נוספת נחוצה כדי להבין אם מנגנונים אפיגנטיים פועלים בדרך כלל בכל המצעים התאיים או רק בתוך תת-קבוצה מסוימת.
הבשלת מיאלין הוצעה גם כאחד הגורמים העיקריים התורמים לירידה בפלסטיות הנוירונית. במהלך תחילתה של פלסטיות תקופה קריטית, אוליגודנדרוציטים מתחילים לבטא חלבונים מבני מיאלין ספציפיים, כולל חלבון מיאלין בסיסי (MBP), גליקופרוטאין הקשור למיאלין (MAG), גליקופרוטאין של מיאלין אוליגודנדרוציטים (OMgp) וחלבון אוליגודנדרוציטים בסיסיים הקשורים למיאלין (MOBP) [ 39]. כאשר המיאלינציה מגיעה לרמות מבוגרים, הפלסטיות של OD מופחתת מאוד או נעדרת. MAG ו-OMgp עשויים לתרום לסגירת תקופה קריטית באמצעות הפעלה של קולטני נוגו. ואכן, עכברים חסרי קולטני נוגו מפגינים פלסטיות OD אפילו בבגרות [40]. מניפולציה של המצב האפיגנטי של אוליגודנדרוציטים עשויה להיות גם אסטרטגיה יעילה לוויסות הפלסטיות. Casaccia-Bonnefil ועמיתיו הראו ששינויי היסטון מעורבים בהתמיינות של תאי מבשר אוליגודנדרוציטים (OPC) במהלך ההתפתחות ובהחלמה מפציעה [41� 43]. מתן מעכב ה-HDAC valproic acid במהלך התקופה הקריטית של תחילת המיאלינציה נמצאה מונעת את הבשלת OPC לתאים מיאלינציה. תוצאות אלו מצביעות על כך שפעילות HDAC במהלך חלון זמני ספציפי של התפתחות לאחר לידה נדרשת לצורך בידול OPC ומיאלינציה. בשלבי התפתחות מאוחרים יותר, דה-אצטילציה של היסטון מתפוגגת ומוחלפת במתילציה היסטונית דכאנית והקמת מבנה כרומטין קומפקטי, האופייני לפנוטיפ האוליגודנדרוציטים המובחן [43]. Shen et al. [44] מצא כי בתגובה לנזק של אוליגודנדרוציטים, רמיאלינציה חזקה התרחשה בבעלי חיים צעירים אך לא בבעלי חיים מבוגרים, עם סינתזת המיאלין החדשה שקדמה לו ויסות מטה של מעכבי התמיינות אוליגודנדרוציטים וסמני תאי גזע עצביים וגיוס HDACs לאזורי פרומטור. גיוס HDAC זה אינו יעיל במוחות מבוגרים, מה שמאפשר הצטברות של מעכבי שעתוק ומניעת ביטוי גן מיאלין. ניתן לגרום להשפעה תלויה גיל זו בעכברים צעירים שטופלו במעכבי HDAC במהלך התקופה שבה מתרחש נזק לאוליגודנטרוציטים. לפיכך, ישנם שינויים אפיגנטיים האופייניים לתקופות של פלסטיות התפתחותית שיכולים לספק מטרה להתערבות טיפולית במקרה של נזק ל-CNS. השימוש במעכבי HDAC להגברת הפלסטיות במוח עשוי להיות גישה טיפולית מבטיחה שכן יש עדויות מתכנסות ממודלים של מכרסמים שטיפול בתרכובות אלו (1) יכול להוביל לשינויים דרמטיים בביטוי הגנים ובהתנהגותם של צאצאים בוגרים שיש להם קיבלו רמות נמוכות של טיפול אימהי [15] ו-(2) מחקים את ההשפעות של EE על היפוך של הפרעות נוירו-התפתחותיות [24]. במקום לייצר עלייה כללית בתעתוק, תרכובות אלו מובילות להפעלה של תת-קבוצה ספציפית של גנים [45-47], מה שמציע התערבות ממוקדת אפשרית להשבת הפלסטיות במוח הבוגר.
מסקנות
ישנן עדויות מתכנסות לתפקידם של שינויים אפיגנטיים כגון אצטילציה של היסטון ומתילציה של DNA הן ביציבות והן בפלסטיות של מעגלים נוירונים מתפתחים. ההשפעות המתמשכות על ביטוי גנים שניתן להשיג באמצעות מנגנונים אלו מספקות מסלול ביולוגי שדרכו חוויות סביבתיות יכולות להיות מוטמעות, מה שמוביל לשינויים ארוכי טווח בנוירוביולוגיה ובהתנהגות. שיפור הפלסטיות במוח הבוגר הוא סיכוי מרגש ובהחלט ישנן עדויות המצביעות על שימוש אפשרי בגורמים אפיגנטיים כדי לגרום למוח "צעיר" יותר. האתגר של מחקרים עתידיים הוא לבסס את המסלולים שבאמצעותם ניתן להשיג שינויים תעתיקים ספציפיים לאתר וגנים ולהבין טוב יותר את המסלול שדרכו חוויות לאורך תוחלת החיים גורמות לפלסטיות מולקולרית זו.
מישל Fagiolini 1, קתרין L ינסן 2 ופרנסס שמפניה 2
דעה נוכחית בנוירוביולוגיה 2009, 19:1�6
סקירה זו באה מתוך נושא נושאים על פיתוח
בעריכת טקאו הנץ ואנדריאה ברנד
0959-4388/$ � ראה עניין קדמי בהוצאת Elsevier Ltd.
DOI 10.1016 / j.conb.2009.05.009
מחבר מקביל: שמפניה, פרנסס א (fac2105@columbia.edu)
[כותרת אקורדיונים = "הפניות"]
[כותרת אקורדיון = "הפניות:" עומס = "הסתר"] 1. מאטיק ג'יי.סי, Amaral PP, Dinger ME, Mercer TR, Mehler MF: RNA
תקנה של תהליכים אפיגנטיים. 2009, 31: 51-59.
2. פנג J, Fouse S, מניפה G: רגולציה אפיגנטית של הגן העצבי
הביטוי והתפקוד העצבתי. מינוח 2007, 61: 58R63R.
3. Razin A: מתילציה CpG, מבנה הכרומטין הגן
השתקה - חיבור משולש. אמבו J 1998, 17: 4905-4908.
4. פוקודה S, Taga T: קביעת גורל סלולרי מוסדר על ידי
רשת אותות תעתיק במוח העכבר המתפתח.
ענת Sci Int 2005, 80: 12-18.
5. מאוורר G, Hutnick L: Methyl-CpG מחייב חלבונים בעצבנות
מערכת. תא זיכרון 2005, 15: 255-261.
6. Strathdee G, בראון R: מתילציה דנ"א חריגה בסרטן:
התערבויות קליניות פוטנציאליות. מומחה Rev Mol Med 2002,
2002: 1-17.
7. Mueller BR, Bale TL: מין ספציפי תכנות של צאצאים
רגשית לאחר מתח מוקדם בהריון. J Neurosci 2008,
28: 9055-9065.
מחקר מכרסמים המדגים שינויים במתילציה של דנ"א של שליה
רקמת המוח בעקבות החשיפה ללחץ הריונית, מתן אפשרי
מנגנון מתווך לטווח ארוך השפעות נוירוביולוגיות של טרום לידתי
חשיפה לפעילות מוגברת של HPA
8. Hoet JJ, הנסון MA: תזונה תוך רחמית: החשיבות שלה
במהלך תקופות קריטיות לב וכלי דם ואנדוקרינית
התפתחות. J פיזיול 1999, 514 (Pt 3): 617-627.
9. Zeisel SH: חשיבות התורמים מתיל במהלך הרבייה.
האם J קליני Nutr 2009, 89: 673S-677S.
10. Lillycrop KA, פיליפס ES, Torrens C, הנסון MA, ג 'קסון AA,
נטל GC: האכלה חולדות בהריון דיאטה מוגבלת חלבון
מתמיד משנה את המתילציה של ציטוזינים ספציפיים
hepatic PPAR מקדם אלפא של הצאצא. Br J Nutr 2008,
100: 278-282.
11. Lillycrop KA, Slater-Jefferies JL, הנסון MA, Godfrey KM,
ג 'קסון AA, Burdge GC: אינדוקציה של epigenetic השתנה
תקנה של קולטן glucocorticoid בכבד ב
צאצא של חולדות ניזון דיאטה מוגבלת חלבון במהלך ההריון
עולה כי מופחתת DNA methyltransferase-1 הביטוי הוא
מעורב במתילציה דנ"א פגומה ושינויים בהיסטון
שינויים. Br J Nutr 2007, 97: 1064-1073.
ממחישה את ההשפעה של תורמים מתיליים בתזונה האימהית על הצאצאים
מתילציה דנ"א דפוסי אצטילון היסטון, מתן חשוב
הקשר בין תזונה ורגולציה גנטית
12. Kovacheva סגן, Mellott TJ, Davison JM, וגנר N, LopezCoviella
אני, שניצלר AC, Blusztajn JK: כולין הריון
חסר גורם ל- DNA ו- Igf2
hypermethylation על ידי upregulation של הביטוי Dnmt1. ג 'ביול
Chem 2007, 282: 31777-31788.
13. Meyey MJ: טיפול אימהי, ביטוי גנים, ואת
שידור של הבדלים אינדיבידואליים בתגובתיות מתח
על פני הדורות. Annu Rev Neurosci 2001, 24: 1161-1192.
14. שמפניה FA, וויבר IC, Diorio J, Dymov S, Szyf M,
מייג 'י: טיפול אימהי קשור מתילציה של
אסטרוגן קולטן- alpha1b האמרגן ו receptoralpha אסטרוגן
ביטוי באזור preoptic המדיאלי של נקבה
צֶאֱצָאִים. אנדוקרינולוגיה 2006, 147: 2909-2915.
15. Weaver IC, Cervoni N, Champagne FA, D�Alessio AC, Sharma S,
Sckl JR, Dymov S, Szyf M, מיני MJ: תכנות אפיגנטי
על ידי התנהגות אימהית. Nat Neurosci 2004, 7: 847-854.
16. Weaver IC, D�Alessio AC, Brown SE, Hellstrom IC, Dymov S,
Sharma S, Szyf M, מייני MJ: גורם שעתוק שעתוק
חלבון גורם לגדילה גורם מתווך epigenetic
תכנות: שינוי סימנים אפיגנטיים על ידי מיידיות מוקדם
גנים. J Neurosci 2007, 27: 1756-1768.
17. Oberlander TF, Weinberg J, Papsdorf M, Grunau R, Misri S,
דוולין AM: חשיפה טרום לידתי לדיכאון אימהי,
מתילציה ניאונלית של קולטן אנושי של קולטן גלוקוקורטי
(NR3C1) ותגובות ללחץ קורטיזול לתינוקות. אפיגנטיקה
2008, 3: 97-106.
מספק עדויות לגבי הרלוונטיות של מנגנונים אפיגנטיים בתיווך
את ההשפעות של מצב רוח אימהי על התפתחות התינוק. ממחיש את
תרגום של גישות ניסיוניות שנערכו במודלים של בעלי חיים
המחקר של נושאים רלוונטיים קלינית בבני אדם
18. McGowan PO, Sasaki A, D�Alessio AC, Dymov S, Labonte B,
ז 'ז, טורקי G, מיני MJ: רגולציה אפיגנטית של
קולטן glucocorticoid במוח האנושי קשרי עם
התעללות בילדות. Nat Neurosci 2009, 12: 342-348.
מספק ראיות משכנעות לנוכחות מתילציה דיפרנציאלית
של GR עם השלכות על ביטוי גנים בהיפוקמפוס האנושי
כפונקציה של התעללות בגיל הרך באמצעות רקמת המוח שהושג
מקרבנות המתאבדים
19. רוט TL, לובין FD, Funk AJ, Sweatt JD: מתמשך epigenetic
השפעה של מצוקה מוקדמת על הגן BDNF. ביול
פסיכיאטריה 2009, 65: 760-769.
מחקר מכוער על ההשפעה הטרנסג'טרלית של החשיפה לאמהות
התעללות בינקות ואת התפקיד של מתילציה דיפרנציאלית של BDNF ב
קליפת המוח הפרה-פרונטאלית בתיווך השפעות אלו
20. שמפניה FA: מנגנונים epigenetic ו
השפעות טרום-לידתיות של טיפול אימהי. חֲזִית
Neuroendocrinol 2008, 29: 386-397.
21. ברואל יונגרמן E, Laroche S, Rampon C: נוירונים חדשים ב
gyrus משונן מעורבים בביטוי של משופרת
זיכרון לטווח ארוך בעקבות העשרה סביבתית.
E J Neurosci 2005, 21: 513-521.
22. שמפניה DL, Bagot RC, ואן Hasselt F, ראמקים G,
מייני, ג 'ולס מ', קרוגרס H: טיפול אימהי
פלסטיות בהיפוקמפוס: ראיות לתלות בחוויה
גמישות מבנית, שינוי בתפקוד הסינפטי, ו
היענות דיפרנציאלית לגלוקוקורטיקואידים ולמתח.
J Neurosci 2008, 28: 6037-6045.
23. אראי JA, לי S, הארטלי DM, Feig LA: הצלה transgenerational של א
פגם גנטי בפוטנציה וזכרון לטווח ארוך
היווצרות העשרה לנוער. J Neurosci 2009, 29: 1496-
1502.
מחקר מכרסמים המדגים את ההשפעה הטרנסגנרלית של הסביבה
העשרה על LTP המציעה כי הגירעונות המושרה גנטית יכול להיות
להתגבר על התנאים הסביבתיים שחוו בעבר
דור
24. פישר א, Sananbenesi F, וואנג X, Dobbin M, Tsai LH: השחזור
של למידה וזיכרון קשורה לכרומטין
שיפוץ. Nature 2007, 447: 178-182.
מחקר מכרסמים מראה כי העשרת הסביבה מגבירה את ההיסטון
acetylation בהיפוקמפוס. מעכבי HDAC גורמים לעלייה במרחב
זיכרון במודל עכבר נוירודגנרטיבי
25. וויליאמס, לואו Y, וורד C, Redd K, גיבסון R, Kuczaj SA,
McCoy JG: העשרת הסביבה: השפעות על המרחב
זיכרון ו immunopactivity בהיפוקמפוס. פיסיול
התנהגות 2001, 73: 649-658.
26. Sweatt JD: שינויים תלויי-חוויית אפיגנטיקה
מערכת העצבים המרכזית. Biol פסיכיאטריה 2009, 65: 191-197.
27. לובין FD, Roth TL, Sweatt JD: רגולציה אפיגנטית של BDNF
תעתיק גנים באיחוד זיכרון הפחד.
J Neurosci 2008, 28: 10576-10586.
מאמרים אחרונים מתוך סדרה של חקירות על ידי מעבדה Sweatt ממחישה
שינויים דינמיים מתילציה דנ"א המתרחשים במהלך התהליך
של למידה ואת התפקיד הקריטי של שינויים אלה באיחוד
של זיכרון
28. לבנסון JM, רוט TL, לובין FD, מילר CA, Huang IC, Desai P,
Malone LM, Sweatt JD: עדות לכך ש- DNA (ציטוזין-5)
methyltransferase מווסת הפלסטיות הסינפטי ב
היפוקמפוס. J Biol כימית 2006, 281: 15763-15773.
29. גואן JS, Haggarty SJ, ג'אקומטי E, Dannenberg JH, יוסף N,
גאו J, Nieland TJ, ג 'ואו Y, וואנג X, Mazitschek R ואח' .: HDAC2
שלילי מסדיר את היווצרות הזיכרון סינפטי
פּלָסטִיוּת. Nature 2009, 459: 55-60.
מחקר בעכברים הבוחנים את יעד ה- HDAC המסוים שדרכו HDAC
inhibitors להפעיל שיפורים פלסטיות סינפטי וזיכרון. שימוש
ממוקד למעלה ו downregulation של HDAC2 המחברים להמחיש את
החשיבות של רמות אנזים זה בתיווך שיפור קוגניטיבי
30. Nelson ED, קוואללי ET, מונטגיה LM: תלות בפעילות
דיכוי של נוירוטרנסמינציה זעירה דרך
תקנה של מתילציה דנ"א. J Neurosci 2008, 28: 395-406.
מאמר זה מתמקד הרגולציה של מתילציה דנ"א ידי NMDA
פעילות סינפטית בתיווך קולטן בתוך נוירונים בוגרים וכיצד
שינויים אפיגנטיים משפיעים על התפקוד הסינפטי הבסיסי. ממצאים אלה
להציע בסיס סינפטי עבור סימפטומים נוירולוגיים הקשורים
הפרעות נוירו-התפתחותיות כמו תסמונת רט
31. חן WG, צ 'נג Q, לין Y, מייסנר א, מערב AE, Griffith EC,
Jaenisch R, גרינברג ME: Derepression של שעתוק BDNF
כרוך זרחון תלוי סידן של MeCP2.
מדע 2003, 302: 885-889.
32. Zhou Z, הונג EJ, כהן S, זאו WN, הו היי, שמידט L,
חן WG, לין Y, Savner E, Griffith EC ואח ': ספציפית למוח
זרחון של MeCP2 מסדיר פעילות BDnf תלויה
תמלול, צמיחה דנדריטית, והתבגרות עמוד השדרה. עֲצָבוֹן
2006, 52: 255-269.
33. מורטי P, Zoghbi היי: MCP2 תפקוד לקוי בתסמונת רט
הפרעות הקשורות. Curr דעות ג 'אנט Dev 2006, 16: 276-281.
34. אדאצ'י M, Autry AE, Covington הוא 3rd, Monteggia LM: MeCP2-
דיכוי שעתוק בתיווך באמיגדלה הבזולטרלית
עשוי לעורר חרדה מוגברת במודל עכבר של רט
תִסמוֹנֶת. J Neurosci 2009, 29: 4218-4227.
35. טרופה D, ואן ווארט, סור M: מנגנונים מולקולריים של
פלסטיות תלויי ניסיון בקליפת המוח החזותית. פילוס טראנס
R סאונד Lond B Biol Sci 2009, 364: 341-355.
36. Medini P, Pizzorusso T: החוויה החזותית ואת הפלסטיות של
קורטקס חזותי: תפקיד מנגנונים אפיגנטיים. קדמי Biosci
2008, 13: 3000-3007.
37. Putignano E, Lonetti G, Cancedda L, Ratto G, קוסטה M, Maffei L,
Pizzorusso T: downregulation התפתחותי של ההיסטון
שינויים פוסט-טרנסלציוניים מווסתים קליפת המוח חזותית
פּלָסטִיוּת. נוירון 2007, 53: 747-759.
המחברים מזהים ERK / MAPK תלוי רגולציה של שינויים היסטון
כמנגנון חדש המונח ביסוד העין
גמישות דומיננטיות
38. Hensch TK: מנגנוני תקופה קריטיים בפיתוח חזותי
קליפת המוח. Curr Top Dev Biol 2005, 69: 215-237.
39. Quarles RH: נרתיקי Myelin: גליקופרוטאינים המעורבים שלהם
היווצרות, תחזוקה והתנוונות. Cell Mol חיים Sci
2002, 59: 1851-1871.
40. מקג 'י AW, יאנג Y, פישר QS, דאו NW, Strittmatter SM:
ניסיון פלסטיות מונע של קליפת המוח חזותית מוגבלת על ידי myelin
ו קולטן Nogo. מדע 2005, 309: 2222-2226.
41. הוא Y, Dupree J, Wang J, Sandoval J, Li J, Liu H, Shi Y, Nave KA,
Casaccia-Bonnefil P: גורם שעתוק Yin יאנג 1 הוא
חיוני להבדל oligodendrocyte אב.
נוירון 2007, 55: 217-230.
42. שן S, Casaccia-Bonnefil P: שינויים לאחר translational
של היסטונים nucleosomal ב השושלת oligodendrocyte
תאי התפתחות ומחלות. J מול Neurosci 2008,
35: 13-22.
43. שן S, Li J, Casaccia-Bonnefil P: שינויים היסטון
להשפיע על העיתוי של oligodendrocyte בידול differiation
במוח החולדה המתפתח. J Cell Biol 2005, 169:
577-589.
44. שן S, Sandoval J, שוויצרי VA, לי J, Dupree J, פרנקלין RJ,
Casaccia-Bonnefil P: בקרת גיל אפיגנטית תלויית גיל
מעכבי בידול הוא קריטי עבור יעילות remimelination.
Nat Neurosci 2008, 11: 1024-1034.
מאמר זה מספק תובנה מכניסטית כיצד מבשרי oligodendrocytes
הבידול התא הוא מוסדר epigenetically במהלך remyelination
וכיצד מנגנונים אלה משתנים עם ההזדקנות.
45. פאס DM, באטלר JE, גודמן RH: פעילות deacetylase הוא
נדרש להפעלת cAMP של קבוצת משנה של יעד CREB
גנים. J Biol כימית 2003, 278: 43014-43019.
46. VCsey CG, הוק JD, Lattal KM, שטיין JM, Fabian SA, Attner MA,
Cabrera SM, McDonough CB, Brindle PK, Abel T et al .: היסטון
מעכבי deacetylase לשפר את הזיכרון ואת הסינפטי
פלסטיות באמצעות CREB: CBP תלוי תמלול ההפעלה.
J Neurosci 2007, 27: 6128-6140.
47. וויבר IC, Meyey MJ, Szyf M: השפעת טיפול אימהי על
התנהגויות בהיפוקמפוס ותהליכי חרדה
בצאצאים הפיכים בבגרותם. Proc Natl אכד
Sci USA 2006, 103: 3480-3485.
[/ אקורדיון]
[/ אקורדיונים]