תקציר אפיגנטי:
השכיחות המוגברת של השמנת יתר ומחלות רקע נלוות היא בעיה מרכזית בבריאות הציבור. בעוד גורמים גנטיים ללא ספק ממלאים תפקיד בקביעת הרגישות האישית לעלייה במשקל והשמנה, הגרסאות הגנטיות שזוהו מסבירות רק חלק מהשונות. עובדה זו הביאה להתעניינות גוברת והולכת בהבנת התפקיד הפוטנציאלי של אפיגנטיקה כמתווכת לאינטראקציות בין גנים לסביבה העומדת ביסוד התפתחות השמנת יתר והפרעות נלוות. ראיות ראשוניות לתמיכה בתפקיד אפיגנטיקה בשמנת יתר וסוג 2 diabetes mellitus (T2DM) נמסרו בעיקר על ידי מחקרים בבעלי חיים, שדיווחו על שינויים אפיגנטיים ברקמות מפתח חשובות מטבולית בעקבות הזנה עשירה בשומנים ובהפרעות אפיגנטיות בין בעלי חיים רזים לשמנים ועל ידי מחקרים בבני אדם, אשר הראו שינויים אפיגנטיים בהשמנת יתר ובגנים המועמדים ל- T2DM אצל אנשים שמנים / סוכרתיים. לאחרונה, ההתקדמות במתודולוגיות אפיגנטיות והוזלת העלות של מחקרי ההתאגדות רחבים (EWAS) הובילו להתרחבות מהירה של מחקרים באוכלוסיות אנושיות. מחקרים אלה דיווחו גם על הבדלים אפיגנטיים בין מבוגרים שמנים / T2DM ובקרה בריאה ושינויים אפיגנטיים בשילוב עם התערבויות תזונתיים, ירידה במשקל ופעילות גופנית. יש גם ראיות גוברות הן ממחקרים אנושיים והן בבעלי חיים, כי הקשר בין חשיפות תזונתיים פרינטאליות לבין סיכון מאוחר יותר להשמנת יתר ו- T2DM עשוי להיות מתווך על ידי שינויים אפיגנטיים בצאצאים. מטרתו של סקירה זו היא לסכם את ההתפתחויות האחרונות בתחום זה זז במהירות, עם דגש מיוחד על EWAS אדם ומחקרים לחקור את ההשפעה של גורמים תזונתיים וסגנון חיים (הן לפני ואחרי) על epigenome ואת הקשר שלהם מטבולית תוצאות בריאות. את הקשיים בהבחנה בין התוצאות לבין סיבתיות במחקרים אלה לבין התפקיד הקריטי של מודלים בבעלי חיים לבדיקת קשרים סיבתיים ומתן תובנה למנגנונים הבסיסיים. לסיכום, האזור של אפיגנטיקה ובריאות מטבולית ראה התפתחויות מהירות בתוך זמן קצר. בעוד שהתוצאות עד כה הן מבטיחות, מחקרים מתמשכים, והעשור הבא מבטיח להיות זמן של מחקר פרודוקטיבי על האינטראקציות המורכבות בין הגנום, האפיגנומה והסביבה כאשר הם קשורים למחלה מטבולית.
מילות מפתח: אפיגנטיקה, מתילציה דנ"א, השמנה, סוג 2 סוכרת, תכנות התפתחותי
תוכן
מבוא
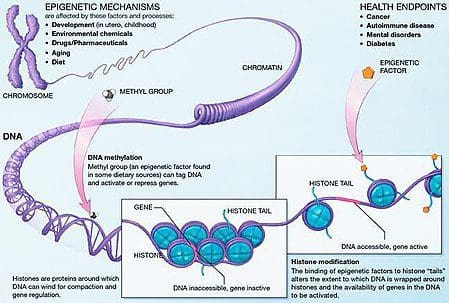 השמנת יתר היא מחלה מורכבת, רב-תחומית, והבנה טובה יותר של המנגנונים שבבסיס יחסי הגומלין בין סגנון חיים, סביבה וגנטיקה היא קריטית לפיתוח אסטרטגיות יעילות למניעה וטיפול [1].
השמנת יתר היא מחלה מורכבת, רב-תחומית, והבנה טובה יותר של המנגנונים שבבסיס יחסי הגומלין בין סגנון חיים, סביבה וגנטיקה היא קריטית לפיתוח אסטרטגיות יעילות למניעה וטיפול [1].
בחברה בה אוכלים צפופים באנרגיה נמצאים בשפע והצורך בפעילות גופנית נמוכה, יש שונות רבה ברגישות של אנשים לפתח בעיות אבטחה ובריאות מטבולית. האומדנים של תפקידה של התורשה בשינוי זה הם בטווח של 40%, ולמרות שמחקרי אסוציאציה גדולים בגנום (GWAS) זיהו מספר לוקוסים גנטיים הקשורים לסיכון להשמנה, ~ 70 הגרסאות הגנטיות הנפוצות ביותר בלבד מהווים אחוזים בודדים של שונות בהשמנת יתר [100, 2]. אומדני הגנום גבוהים יותר, ומהווים ~ 3% מהשונות [20]; עם זאת, חלק גדול מהתורשה נותר בלתי מוסבר.
לאחרונה הופנתה תשומת הלב לחקירת תפקידם של שינויים אפיגנטיים באטיולוגיה של השמנת יתר. נטען כי האפיגנום עשוי לייצג את הקשר המכניסטי בין וריאנטים גנטיים לבין גורמים סביבתיים בקביעת הסיכון להשמנה ויכול לסייע בהסבר את התורשה המבקשת. המחקרים האפיגנטיים האנושיים הראשונים היו קטנים ורק נחקרו מספר מוגבל של לוקוסים. בעוד שבדרך כלל זה הביא לשחזור לקוי, חלק מהממצאים המוקדמים הללו, למשל הקשר בין מתילציה של PGC1A לבין סוכרת מסוג 2 (T2DM) [4] ואחרים כפי שנדון ב- van Dijk et al. [5], הועתקו במחקרים מאוחרים יותר. ההתקדמות האחרונה והמחישות המוגברת של טכנולוגיות תפוקה גבוהה מאפשרות כעת מחקרי אסוציאציה רחבים של אפיגנום (EWAS) ושילוב של שכבות שונות של מידע גנומי כדי לחקור את האינטראקציות המורכבות בין הגנוטיפ, האפיגנום, התעתיק והסביבה [6 9]. מחקרים אלה עדיין בחיתוליהם, אך התוצאות עד כה הראו הבטחה לסייע בהסבר השונות ברגישות להשמנת יתר.
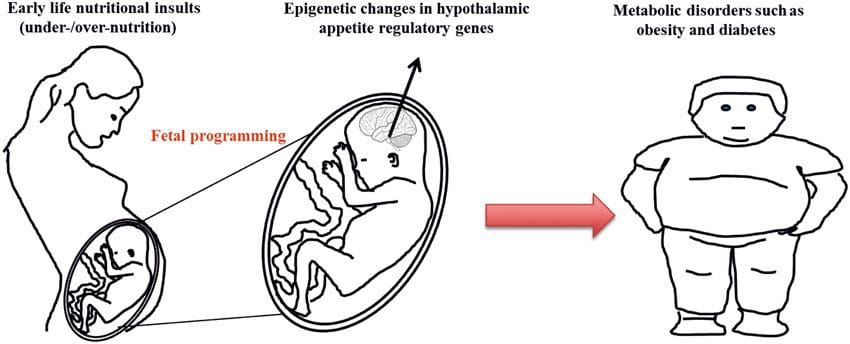
ישנן עדויות הולכות וגוברות לכך שההשמנה התפתחה במקורות נפשיים, מכיוון שחשיפה לאספקת תזונה לא אופטימלית לפני הלידה או בגיל הרך קשורה לסיכון מוגבר להשמנת יתר ולמחלות מטבוליות בשלב מאוחר יותר של החיים [10]. בתחילה, מחקרים בבעלי חיים הראו כי טווח של חשיפות תזונתיות מוקדמות לחיים, במיוחד אלה שנחשפו בשלב מוקדם של ההריון, יכול לגרום לשינויים אפיגנטיים ברקמות המטבוליות העיקריות של הצאצאים שנמשכו לאחר הלידה ולהביא לשינויים קבועים בתפקוד הגנטי [13]. ישנן עדויות התומכות בקיומו של אותו מנגנון בבני אדם. זה הוביל לחיפוש אחר סימנים אפיגנטיים המופיעים בשלב מוקדם בחיים המנבאים סיכון מאוחר יותר למחלות מטבוליות, ומחקרים כדי לקבוע האם ניתן למנוע או להפוך תכנות אפיגנטיות למחלות מטבוליות בשלב מאוחר יותר.
סקירה זו מספקת עדכון של הסקירה השיטתית הקודמת שלנו על מחקרים על אפיגנטיקה והשמנת יתר בבני אדם [5]. הסקירה הקודמת שלנו הראתה את התוצאות המבטיחות של מחקרים ראשוניים, כולל הסימנים האפיגנטיים הפוטנציאליים הראשונים להשמנת יתר שיכולים להתגלות בלידה (למשל, RXRA) [18]. עם זאת, היא גם הדגישה את ההתרבות המוגבלת של הממצאים ואת היעדרם של מחקרים ארוכי טווח בקנה מידה גדול. הסקירה הנוכחית מתמקדת בהתפתחויות האחרונות בתחום זה זז במהירות, בפרט, על EWAS האדם ומחקרים לחקור את ההשפעה של (תזונתיים לפני ואחרי) תזונתיים גורמים חיים על epigenome ואת התפקיד המתעוררים של אפיגנטיקה הפתולוגיה של השמנת יתר . כמו כן, אנו עוסקים בקשיים בזיהוי סיבתיות במחקרים אלה ובחשיבותם של מודלים בבעלי חיים במתן תובנות לגבי מנגנונים.
סקירה
שינויים אפיגנטיים במודלים של בעלי חיים של השמנה
 מודלים של בעלי חיים מספקים הזדמנויות ייחודיות למחקרים מבוקרים מאוד המספקים תובנה מכניסטית לגבי תפקידם של סימנים אפיגנטיים ספציפיים, הן כמדדים למצב חילוף החומרים הנוכחי והן כמנבאים את הסיכון העתידי להשמנה ולמחלות מטבוליות. היבט חשוב במיוחד של מחקרים בבעלי חיים הוא שהם מאפשרים הערכה של שינויים אפיגנטיים ברקמות היעד, כולל הכבד וההיפותלמוס, וזה הרבה יותר קשה בבני אדם. יתר על כן, היכולת לקצור כמויות גדולות של רקמות טריות מאפשרת להעריך מספר סימני כרומטין וכן מתילציה של DNA. חלק מהשינויים האפיגנטיים הללו לבד או בשילוב עשויים להיות מגיבים לתכנות סביבתי. במודלים של בעלי חיים ניתן גם לחקור דורות מרובים של צאצאים ובכך לאפשר הבחנה בין העברה בין-דורית לבין בין-דורית של סיכון להשמנת יתר בתיווך זיכרון אפיגנטי במצב תזונתי של ההורים, שלא ניתן להבחין בו בקלות במחקרי אנוש. אנו משתמשים במונח הקודם להעברת סיכון מיוטי בהיעדר חשיפה מתמשכת ואילו האחרון כרוך בעיקר בהעברת ישיר של סיכון באמצעות תכנות מחדש מטבולי של העובר או הגומטיקה.
מודלים של בעלי חיים מספקים הזדמנויות ייחודיות למחקרים מבוקרים מאוד המספקים תובנה מכניסטית לגבי תפקידם של סימנים אפיגנטיים ספציפיים, הן כמדדים למצב חילוף החומרים הנוכחי והן כמנבאים את הסיכון העתידי להשמנה ולמחלות מטבוליות. היבט חשוב במיוחד של מחקרים בבעלי חיים הוא שהם מאפשרים הערכה של שינויים אפיגנטיים ברקמות היעד, כולל הכבד וההיפותלמוס, וזה הרבה יותר קשה בבני אדם. יתר על כן, היכולת לקצור כמויות גדולות של רקמות טריות מאפשרת להעריך מספר סימני כרומטין וכן מתילציה של DNA. חלק מהשינויים האפיגנטיים הללו לבד או בשילוב עשויים להיות מגיבים לתכנות סביבתי. במודלים של בעלי חיים ניתן גם לחקור דורות מרובים של צאצאים ובכך לאפשר הבחנה בין העברה בין-דורית לבין בין-דורית של סיכון להשמנת יתר בתיווך זיכרון אפיגנטי במצב תזונתי של ההורים, שלא ניתן להבחין בו בקלות במחקרי אנוש. אנו משתמשים במונח הקודם להעברת סיכון מיוטי בהיעדר חשיפה מתמשכת ואילו האחרון כרוך בעיקר בהעברת ישיר של סיכון באמצעות תכנות מחדש מטבולי של העובר או הגומטיקה.
מחקרים בבעלי חיים מילאו תפקיד קריטי בהבנתנו הנוכחית את תפקיד האפיגנטיקה במקורות ההתפתחותיים של השמנת יתר ו- T2DM. גם תזונה אימהית מוגברת וגם ירידה במהלך ההריון נקשרו לתצהיר שומן מוגבר אצל צאצאי מרבית מיני היונקים שנחקרו עד כה (נבדק ב- [11, 13, 15]). לתזונת האם במהלך ההריון לא רק יש פוטנציאל להשפעה ישירה על העובר, היא גם עשויה להשפיע באופן ישיר על הביציות המתפתחות של עוברים נקביים ועל תאי נבט קדומים של עוברים זכרים ולכן יכולה להשפיע גם על צאצאי האבא וגם על צאצאיהם. לפיכך, בדרך כלל נדרשים נתונים רב-דוריים בכדי להבדיל בין מנגנוני העברה אימהיים לבין מנגנוני העברה בין-דוריים.
לוח 1 מסכם מגוון של מודלים של בעלי חיים אשר שימשו כדי לספק ראיות לשינויים מטבוליים אפיגנטיים בצאצאים הקשורים המטוס ההורים של תזונה. הוא מכיל גם מידע על מחקרים המזהים סימנים אפיגנטיים שונים אצל אנשים בוגרים שעוברים אתגרים תזונתיים ישירים. הטבלה מובנית על ידי סוג שידור הסיכון המוצע.
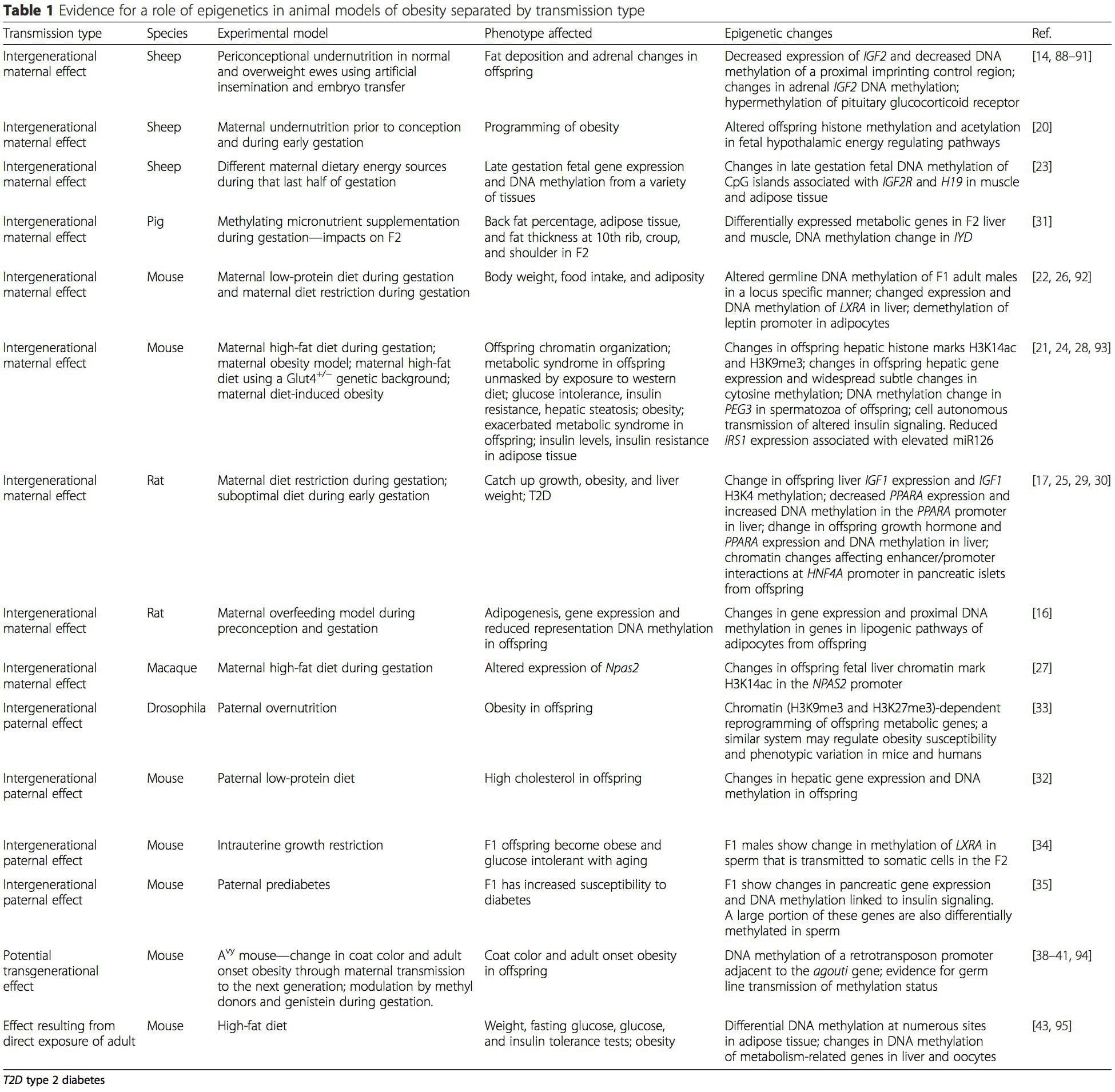 (i) שינויים epigenetic ב צאצאים הקשורים לתזונה אימהית במהלך ההמולה
(i) שינויים epigenetic ב צאצאים הקשורים לתזונה אימהית במהלך ההמולה
 תוספי תזונה אימהיים, תת תזונה ועודף תזונה במהלך ההריון יכולים לשנות את שקיעת השומן והומאוסטזיס האנרגיה אצל צאצאים [11, 13, 15]. הקשורים להשפעות אלו אצל הצאצאים הם שינויים במתילציה של ה- DNA, שינויים בהיסטון לאחר טרנסלציוני וביטוי גנים למספר גני יעד, במיוחד גנים המווסתים את חילוף החומרים של חומצות שומן ואיתות אינסולין [19, 16, 17:20]. מגוון המודלים של בעלי חיים ששימשו במחקרים אלה והמסלולים המטבוליים הנפוצים שהושפעו מרמזים על תגובה אדפטיבית שנשמרה מבחינה אבולוציונית המתווכת על ידי שינוי אפיגנטי. עם זאת, מעט מהגנים המזוהים הספציפיים והשינויים האפיגנטיים זכו לאימות צולב במחקרים קשורים, ובדרך כלל לא יושמו חקירות רחבות גנום. מכשול מרכזי להשוואה בין מחקרים אלו הוא חלונות הנפש השונים המפתחים לאתגר תזונתי, אשר עשויים לגרום לתוצאות שונות במידה ניכרת. נדרשת גם הוכחה שהשינויים האפיגנטיים הם סיבתיים ולא קשורים לשינויים פנוטיפיים בצאצאים. זה יחייב זיהוי של תגובת זיכרון אפיגנטית הנגרמת מבחינה תזונתית של ההורים שקדמה להתפתחות הפנוטיפ שהשתנה אצל צאצאים.
תוספי תזונה אימהיים, תת תזונה ועודף תזונה במהלך ההריון יכולים לשנות את שקיעת השומן והומאוסטזיס האנרגיה אצל צאצאים [11, 13, 15]. הקשורים להשפעות אלו אצל הצאצאים הם שינויים במתילציה של ה- DNA, שינויים בהיסטון לאחר טרנסלציוני וביטוי גנים למספר גני יעד, במיוחד גנים המווסתים את חילוף החומרים של חומצות שומן ואיתות אינסולין [19, 16, 17:20]. מגוון המודלים של בעלי חיים ששימשו במחקרים אלה והמסלולים המטבוליים הנפוצים שהושפעו מרמזים על תגובה אדפטיבית שנשמרה מבחינה אבולוציונית המתווכת על ידי שינוי אפיגנטי. עם זאת, מעט מהגנים המזוהים הספציפיים והשינויים האפיגנטיים זכו לאימות צולב במחקרים קשורים, ובדרך כלל לא יושמו חקירות רחבות גנום. מכשול מרכזי להשוואה בין מחקרים אלו הוא חלונות הנפש השונים המפתחים לאתגר תזונתי, אשר עשויים לגרום לתוצאות שונות במידה ניכרת. נדרשת גם הוכחה שהשינויים האפיגנטיים הם סיבתיים ולא קשורים לשינויים פנוטיפיים בצאצאים. זה יחייב זיהוי של תגובת זיכרון אפיגנטית הנגרמת מבחינה תזונתית של ההורים שקדמה להתפתחות הפנוטיפ שהשתנה אצל צאצאים.
(2) ההשפעות של תזונה אבהי על הצאצאים אפיגנטיקה
 מחקרים מתעוררים הוכיחו כי מישור תזונה אבהי יכול להשפיע על שקיעת שומן בצאצאים וסימני אפיגנטיקה [31 34]. אחת מחקירות האחרונות שעשתה שימוש בעכברים הוכיחה כי טרום סוכרת אבהית מובילה לרגישות מוגברת לסוכרת אצל צאצאי F1 עם שינויים נלווים בביטוי גנים בלבלב ומתילציה של DNA הקשורים לאיתור אינסולין [35]. חשוב לציין, הייתה חפיפה של שינויים אפיגנטיים אלה באיי הלבלב ובזרע המציעים תורשת של קו נבט. עם זאת, מרבית המחקרים הללו, למרות שהם מסקרנים בהשלכותיהם, מוגבלים בסולם הגנומי של החקירה ולעתים קרובות מראים שינויים אפיגנטיים חלשים וחולפים במקצת הקשורים לפנוטיפים מטבוליים קלים אצל צאצאים.
מחקרים מתעוררים הוכיחו כי מישור תזונה אבהי יכול להשפיע על שקיעת שומן בצאצאים וסימני אפיגנטיקה [31 34]. אחת מחקירות האחרונות שעשתה שימוש בעכברים הוכיחה כי טרום סוכרת אבהית מובילה לרגישות מוגברת לסוכרת אצל צאצאי F1 עם שינויים נלווים בביטוי גנים בלבלב ומתילציה של DNA הקשורים לאיתור אינסולין [35]. חשוב לציין, הייתה חפיפה של שינויים אפיגנטיים אלה באיי הלבלב ובזרע המציעים תורשת של קו נבט. עם זאת, מרבית המחקרים הללו, למרות שהם מסקרנים בהשלכותיהם, מוגבלים בסולם הגנומי של החקירה ולעתים קרובות מראים שינויים אפיגנטיים חלשים וחולפים במקצת הקשורים לפנוטיפים מטבוליים קלים אצל צאצאים.
(iii) שינויים אפשריים בין-דוריים אפיגנטיים לקידום הפקדת שומן בצאצאים
 שידור יציב של מידע אפיגנטי על פני דורות מרובים מתואר היטב במערכות צמחים ו- C. elegans, אך משמעותה אצל יונקים עדיין נידונה רבות [36, 37]. בסיס אפיגנטי להעברה של פנוטיפים גדולים על ידי ההורים בתגובה לחשיפות תזונתיות הוקם היטב, כולל במיני בעלי חיים [31]. המחקרים המשפיעים ביותר שהוכיחו השפעות של העברה אפיגנטית המשפיעים על פנוטיפ הצאצאים השתמשו בדוגמה של עכבר האגוטי הצהוב (אבי) (38) בעכבר זה, החדרה של רטרוטרנספוזון במעלה הזרם של הגן האגוטי גורמת לביטוי המכונן שלו וכתוצאה מכך לצבע המעיל הצהוב ולהשמנת יתר של מבוגרים. העברת אמהות דרך קו הנבט גורמת למתילציה של דנ"א. השתקה אמצעית של ביטוי אגוטי וכתוצאה מכך צבע מעילי פראי ופנוטיפ רזה של הצאצאים [39, 40]. חשוב לציין כי מחקרים שלאחר מכן בעכברים אלה הראו כי חשיפה אימהית לתורמי מתיל גורמת לשינוי בצבע המעיל [41]. מחקר אחד דיווח על העברת פנוטיפ לדור ה- F3 ושינויים בביטוי למספר רב של גנים בתגובה להגבלת חלבונים ב- F0 [42]; עם זאת, שינויים בביטוי היו משתנים מאוד וקשר ישיר לשינויים אפיגנטיים לא זוהה במערכת זו.
שידור יציב של מידע אפיגנטי על פני דורות מרובים מתואר היטב במערכות צמחים ו- C. elegans, אך משמעותה אצל יונקים עדיין נידונה רבות [36, 37]. בסיס אפיגנטי להעברה של פנוטיפים גדולים על ידי ההורים בתגובה לחשיפות תזונתיות הוקם היטב, כולל במיני בעלי חיים [31]. המחקרים המשפיעים ביותר שהוכיחו השפעות של העברה אפיגנטית המשפיעים על פנוטיפ הצאצאים השתמשו בדוגמה של עכבר האגוטי הצהוב (אבי) (38) בעכבר זה, החדרה של רטרוטרנספוזון במעלה הזרם של הגן האגוטי גורמת לביטוי המכונן שלו וכתוצאה מכך לצבע המעיל הצהוב ולהשמנת יתר של מבוגרים. העברת אמהות דרך קו הנבט גורמת למתילציה של דנ"א. השתקה אמצעית של ביטוי אגוטי וכתוצאה מכך צבע מעילי פראי ופנוטיפ רזה של הצאצאים [39, 40]. חשוב לציין כי מחקרים שלאחר מכן בעכברים אלה הראו כי חשיפה אימהית לתורמי מתיל גורמת לשינוי בצבע המעיל [41]. מחקר אחד דיווח על העברת פנוטיפ לדור ה- F3 ושינויים בביטוי למספר רב של גנים בתגובה להגבלת חלבונים ב- F0 [42]; עם זאת, שינויים בביטוי היו משתנים מאוד וקשר ישיר לשינויים אפיגנטיים לא זוהה במערכת זו.
(4) חשיפה ישירה של אנשים לתזונה עודפת בחיים שלאחר הלידה
 בעוד שמחקרים רבים זיהו שינויים אפיגנטיים הקשורים לדיאטה במודלים של בעלי חיים, תוך שימוש במועמדים ספציפיים לאתר, הועברו כמה ניתוחים בגנום. מחקר שנערך לאחרונה התמקדו בקביעת ההשפעה האפיגנטית הישירה של דיאטות עתירי שומן / דיאטה המושרה על ידי דיאטה בעכברים בוגרים באמצעות ביטוי גנומי רחב של גנים וניתוח מתילציה של דנ"א [43]. מחקר זה זיהה 232 דיפרנציאלי methylated אזורים (DMRs) ב adipocytes מ שליטה גבוהה שומן fed עכברים. חשוב לציין, האזורים האנושיים המתאימים עבור DMRs Murine היו גם מתילציה דיפרנציאלי ברקמת השומן מאוכלוסייה של בני אדם שמנים ורזים, ובכך להדגיש את שימור אבולוציוני מדהים של אזורים אלה. תוצאה זו מדגישה את החשיבות האפשרית של DMRs מזוהים ויסות האנרגיה הומאוסטזיס אצל יונקים.
בעוד שמחקרים רבים זיהו שינויים אפיגנטיים הקשורים לדיאטה במודלים של בעלי חיים, תוך שימוש במועמדים ספציפיים לאתר, הועברו כמה ניתוחים בגנום. מחקר שנערך לאחרונה התמקדו בקביעת ההשפעה האפיגנטית הישירה של דיאטות עתירי שומן / דיאטה המושרה על ידי דיאטה בעכברים בוגרים באמצעות ביטוי גנומי רחב של גנים וניתוח מתילציה של דנ"א [43]. מחקר זה זיהה 232 דיפרנציאלי methylated אזורים (DMRs) ב adipocytes מ שליטה גבוהה שומן fed עכברים. חשוב לציין, האזורים האנושיים המתאימים עבור DMRs Murine היו גם מתילציה דיפרנציאלי ברקמת השומן מאוכלוסייה של בני אדם שמנים ורזים, ובכך להדגיש את שימור אבולוציוני מדהים של אזורים אלה. תוצאה זו מדגישה את החשיבות האפשרית של DMRs מזוהים ויסות האנרגיה הומאוסטזיס אצל יונקים.
לימודי אנוש
בהסתמך על הראיות ממחקרים בבעלי חיים ועם הזמינות הגוברת של כלים סבירים לניתוח גנומי רחב, חלה התרחבות מהירה של מחקרים epigenome בבני אדם. מחקרים אלה התמקדו בעיקר בזיהוי ההבדלים הספציפיים לאתר במתילציה של דנ"א, הקשורים לפנוטיפים מטבוליים.
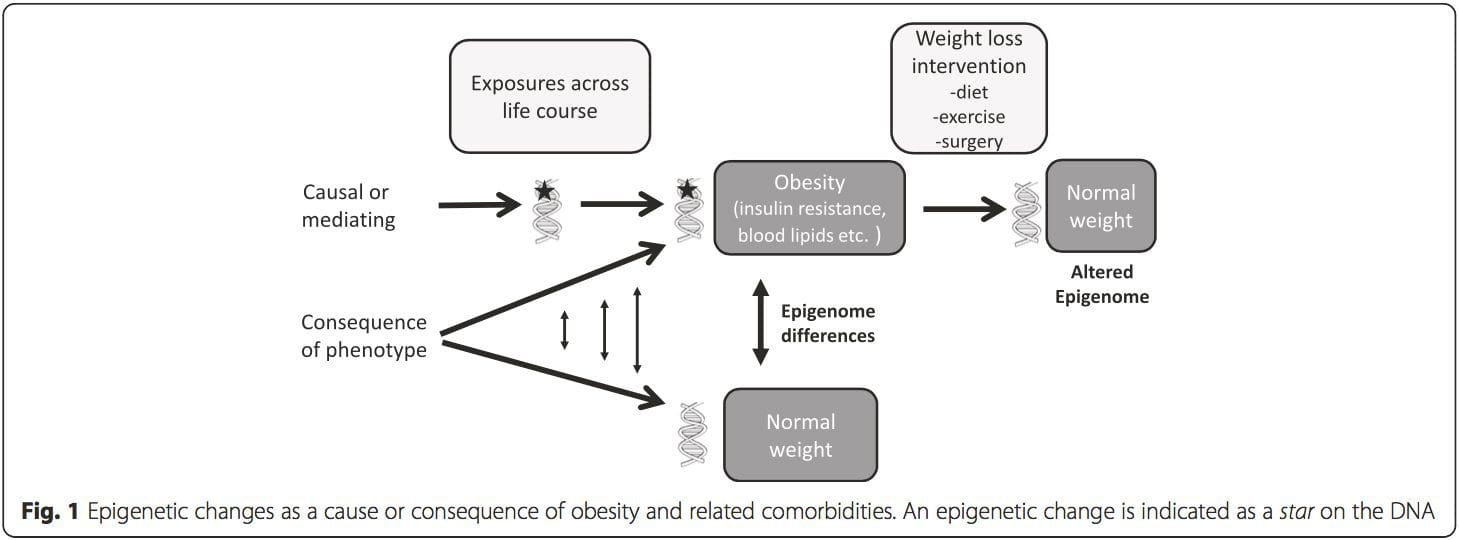
שאלת מפתח היא עד כמה שינויים אפיגנטיים תורמים להתפתחות הפנוטיפ המטבולי, ולא רק להיות רצף של אותו (איור 1). תכנות אפיגנטי יכול לתרום להתפתחות השמנת יתר, כמו גם משחק תפקיד בסיכון כתוצאה של בעיות לב וכלי דם ומטבולי. במחקרי אנוש קשה להוכיח סיבתיות, אך ניתן להסיק ממספר שורות של ראיות:
 (i) מחקרים על קשר גנטי. פולימורפיזמים גנטיים הקשורים לסיכון מוגבר לפתח מצבים מסוימים קשורים מראש לגנים הסיבתיים. נוכחותם של מתילציה דיפרנציאלית באזורים כאלה גורמת לרלוונטיות תפקודית של שינויים אפיגנטיים אלה בשליטה על הביטוי של הגן הפרוקסימלי. ישנן השפעות גנטיות חזקות הפועלות על ידי סיס, העומדות בבסיס שונות אפיגנטית רבה [7, 45], ובמחקרים מבוססי אוכלוסייה הוחלו שיטות המשתמשות בפונדקאות גנטיות כדי להסיק תפקיד סיבתי או מתווך של הבדלי אפיגנום [7, 46 48] . השימוש במידע גנטי משפחתי יכול גם להוביל לזיהוי אזורי מועמדים שעלולים לגרום למציאת מתילציה דיפרנציאלית הקשורה לפנוטיפ [49].
(i) מחקרים על קשר גנטי. פולימורפיזמים גנטיים הקשורים לסיכון מוגבר לפתח מצבים מסוימים קשורים מראש לגנים הסיבתיים. נוכחותם של מתילציה דיפרנציאלית באזורים כאלה גורמת לרלוונטיות תפקודית של שינויים אפיגנטיים אלה בשליטה על הביטוי של הגן הפרוקסימלי. ישנן השפעות גנטיות חזקות הפועלות על ידי סיס, העומדות בבסיס שונות אפיגנטית רבה [7, 45], ובמחקרים מבוססי אוכלוסייה הוחלו שיטות המשתמשות בפונדקאות גנטיות כדי להסיק תפקיד סיבתי או מתווך של הבדלי אפיגנום [7, 46 48] . השימוש במידע גנטי משפחתי יכול גם להוביל לזיהוי אזורי מועמדים שעלולים לגרום למציאת מתילציה דיפרנציאלית הקשורה לפנוטיפ [49].
(ii) תזמון שינויים אפיגנטיים. נוכחותו של סימן אפיגנטי לפני התפתחות הפנוטיפ היא תכונה חיונית הקשורה לסיבתיות. לעומת זאת, נוכחות של סימן בשילוב עם השמנת יתר, אך לא לפני התפתחותו, ניתן להשתמש כדי להוציא סיבתיות, אבל לא היה להוציא את התפקיד האפשרי שלאחר מכן הקשורים להשמנה פתולוגיה.
(iii) היגיון סביר של מנגנון. זה מתייחס לשינויים אפיגנטיים הקשורים לשינוי ביטוי של גנים עם תפקיד קבוע בוויסות הפנוטיפ של עניין. דוגמה אחת כזו היא הקשר של מתילציה בשני אתרי CpG בגן CPT1A עם רמות טריגליצרידים במחזור [50]. CPT1A מקודד קרניטין palmitoyltransferase 1A, אנזים עם תפקיד מרכזי בחילוף החומרים של חומצות שומן, וזה מעיד מאוד על כך שמתילציה דיפרנציאלית של גן זה עשויה להיות קשורה בסיבתיות לשינויים בריכוז הטריגליצרידים בפלסמה.
אפיגנום- Wide האגודה מחקרים: זיהוי ביומרקרים אפיגנטיים של בריאות מטבולית
מספר מחקרים שנערכו לאחרונה התמקדו בחקר קשרים בין השמנת יתר / מחלות מטבוליות לבין מתילציה של DNA ברחבי הגנום (טבלה 2). ה- EWAS הגדול ביותר שפורסם עד כה, כולל סך של 5465 אנשים, זיהה 37 אתרי מתילציה בדם אשר נקשרו למדד מסת הגוף (BMI), כולל אתרים ב- CPT1A, ABCG1 ו- SREBF1 [51]. מחקר רחב היקף נוסף הראה קשר עקבי בין BMI למתילציה ב- HIF3A בדם מלא וברקמת השומן [52], ממצא ששוכפל בחלקו גם במחקרים אחרים [9, 51]. קשרים אחרים שדווחו לאחרונה בין מדדים הקשורים להשמנה לבין מתילציה של DNA כוללים (i) הבדלים של מתילציה של DNA בין רזה לבין שָׁמֵן מְאֹד אנשים ב- LY86 בלוקוציטים בדם [53]; (ii) קשרים בין מתילציה של מקדם PGC1A בדם מלא של ילדים לבין שומן 5 שנים מאוחר יותר [54]; (iii) קשרים בין יחס המותניים-הירך לבין מתילציה של ADRB3 בדם [55]; ו- (iv) קשרים בין BMI, מדדי חלוקת שומן בגוף, ואתרי מתילציה מרובים של DNA ברקמת השומן [9, 56]. EWAS הראו קשרים בין אתרי מתילציה של DNA לבין שומנים בדם [55, 57], מטבוליטים בסרום [59], עמידות לאינסולין [60, 9] ו- T61DM [2, 48, 62] (טבלה 63).
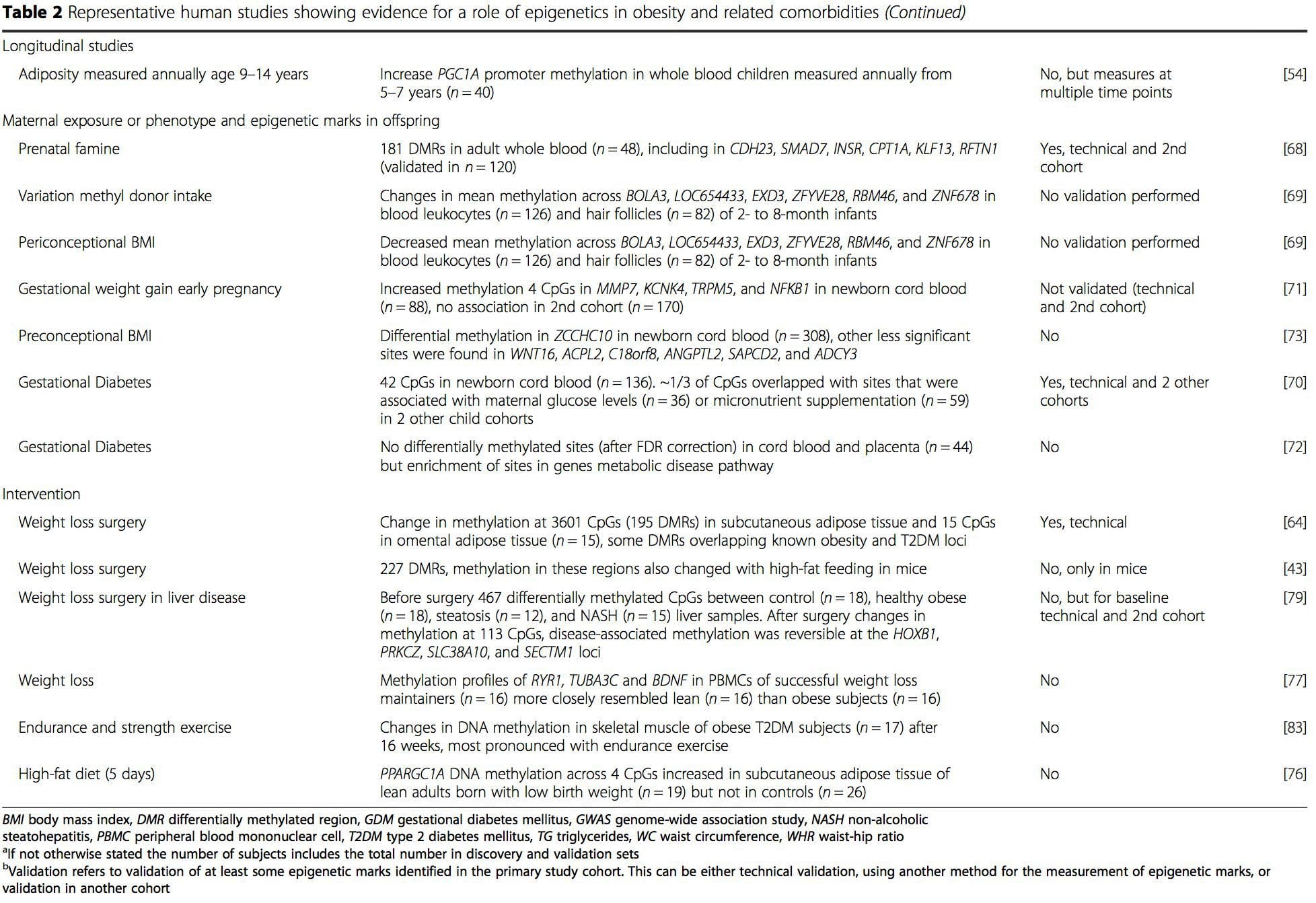 ממחקרים אלה, מתילציה שונה של PGC1A, HIF3A, ABCG1, ו- CPT1A ו- RXRA [18] המתוארים לעיל, התפתחו כסימנים ביולוגיים הקשורים לבריאות מטבולית, או אולי מנבאים, שגם הם מועמדים סבירים לתפקיד של התפתחות מחלות מטבוליות .
ממחקרים אלה, מתילציה שונה של PGC1A, HIF3A, ABCG1, ו- CPT1A ו- RXRA [18] המתוארים לעיל, התפתחו כסימנים ביולוגיים הקשורים לבריאות מטבולית, או אולי מנבאים, שגם הם מועמדים סבירים לתפקיד של התפתחות מחלות מטבוליות .
אינטראקציה בין גנוטיפ לבין אפיגנום
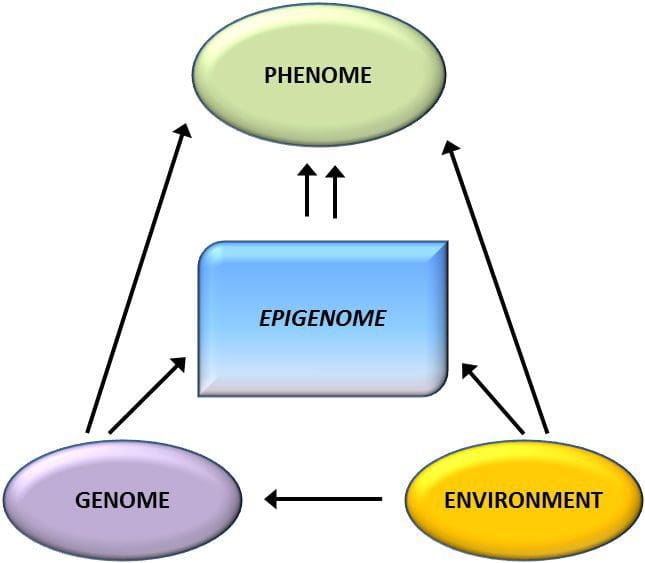 וריאציה אפיגנטית מושפעת מאוד מהווריאציה הגנטית הבסיסית, כאשר הגנוטיפ מוערך כמסביר ~ 20% מהשונות [40, 6]. לאחרונה, מספר מחקרים החלו לשלב נתונים על מתילום וגנוטיפ לזיהוי לוקוסים של תכונות כמותיות (meQTL) הקשורות לפנוטיפים של מחלות. לדוגמא, ברקמת השומן, זוהה meQTL עם מקום סיכון גנטי של BMI באלמנט משפר במעלה הזרם של ADCY8 [3]. מחקרים אחרים זיהו גם חפיפות בין השמנת יתר ידועה לבין לוקוסים בסיכון T8DM ו- DMR הקשורים להשמנה ו- T2DM [2, 43, 48]. מתילציה של מספר תרופות מסוג DMR כאלה הותאמה גם על ידי האכלה עשירה בשומן בעכברים [62] וירידה במשקל בבני אדם [43]. תוצאות אלו מזהות קשר מסקרן בין וריאציות גנטיות הקשורות לרגישות למחלות לבין הקשר שלהן לאזורי הגנום העוברים שינויים אפיגנטיים בתגובה לאתגרים תזונתיים, המרמזים על קשר סיבתי. הקשר ההדוק בין וריאציה גנטית לאפיגנטית עשוי לסמן את תפקידם המהותי ביצירת וריאציה פרטנית [64, 65]. עם זאת, בעוד שממצאים אלה מצביעים על כך שמתילציה של DNA עשויה להיות מתווך של השפעות גנטיות, חשוב גם לקחת בחשבון שתהליכים גנטיים ואפיגנטיים יכולים לפעול באופן עצמאי על אותם גנים. מחקרים תאומים [66, 8, 63] יכולים לספק תובנות חשובות ולהצביע על כך שההבדלים הבין-אישיים ברמות המתילציה של ה- DNA נובעים בעיקר מסביבה שאינה משותפת והשפעות סטוכסטיות, באופן מינימלי מהשפעות סביבתיות משותפות, אך גם עם השפעה משמעותית של גנטיות. וָרִיאַצִיָה.
וריאציה אפיגנטית מושפעת מאוד מהווריאציה הגנטית הבסיסית, כאשר הגנוטיפ מוערך כמסביר ~ 20% מהשונות [40, 6]. לאחרונה, מספר מחקרים החלו לשלב נתונים על מתילום וגנוטיפ לזיהוי לוקוסים של תכונות כמותיות (meQTL) הקשורות לפנוטיפים של מחלות. לדוגמא, ברקמת השומן, זוהה meQTL עם מקום סיכון גנטי של BMI באלמנט משפר במעלה הזרם של ADCY8 [3]. מחקרים אחרים זיהו גם חפיפות בין השמנת יתר ידועה לבין לוקוסים בסיכון T8DM ו- DMR הקשורים להשמנה ו- T2DM [2, 43, 48]. מתילציה של מספר תרופות מסוג DMR כאלה הותאמה גם על ידי האכלה עשירה בשומן בעכברים [62] וירידה במשקל בבני אדם [43]. תוצאות אלו מזהות קשר מסקרן בין וריאציות גנטיות הקשורות לרגישות למחלות לבין הקשר שלהן לאזורי הגנום העוברים שינויים אפיגנטיים בתגובה לאתגרים תזונתיים, המרמזים על קשר סיבתי. הקשר ההדוק בין וריאציה גנטית לאפיגנטית עשוי לסמן את תפקידם המהותי ביצירת וריאציה פרטנית [64, 65]. עם זאת, בעוד שממצאים אלה מצביעים על כך שמתילציה של DNA עשויה להיות מתווך של השפעות גנטיות, חשוב גם לקחת בחשבון שתהליכים גנטיים ואפיגנטיים יכולים לפעול באופן עצמאי על אותם גנים. מחקרים תאומים [66, 8, 63] יכולים לספק תובנות חשובות ולהצביע על כך שההבדלים הבין-אישיים ברמות המתילציה של ה- DNA נובעים בעיקר מסביבה שאינה משותפת והשפעות סטוכסטיות, באופן מינימלי מהשפעות סביבתיות משותפות, אך גם עם השפעה משמעותית של גנטיות. וָרִיאַצִיָה.
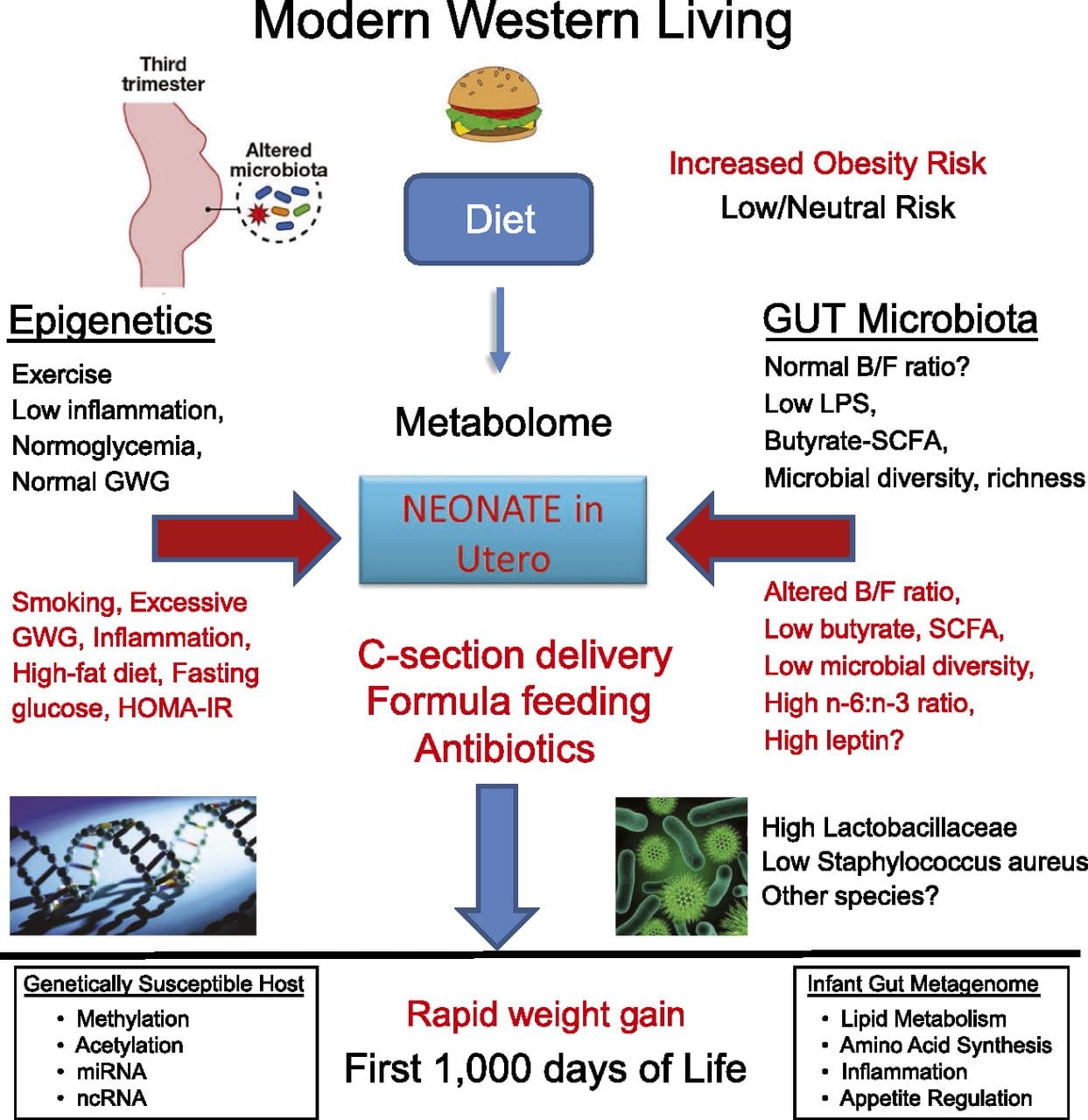
ההשפעה של הסביבה טרום לידתי ואחרי על Epigenome
 סביבה טרום לידתי: שני מחקרים שפורסמו לאחרונה עשו שימוש באוכלוסיות אנושיות שחוו שינויים "טבעיים" באספקת התזונה כדי לחקור את ההשפעה של תזונת האם לפני או במהלך ההריון על מתילציה של DNA אצל הצאצאים [68, 69]. במחקר הראשון נעשה שימוש בקבוצת אם-ילד בגמביה כדי להראות כי הן שינויים עונתיים בצריכת תורם מתיל מצד האם במהלך ההריון והן BMI לפני הריון מצד האם נקשרו למתילציה שונה אצל התינוקות [69]. המחקר השני השתמש בצאצאים בוגרים מקבוצת הרעב ההולנדי לחקר ההשפעה של חשיפה לפני הלידה לתקופה חריפה של תת תזונה אימהית קשה על מתילציה של DNA של גנים המעורבים בגדילה ובמטבוליזם בבגרות [68]. התוצאות הדגישו את החשיבות של עיתוי החשיפה בהשפעתה על האפיגנום, שכן השפעות אפיגנטיות משמעותיות זוהו רק אצל אנשים שנחשפו לרעב במהלך ההיריון המוקדם. חשוב לציין כי השינויים האפיגנטיים התרחשו יחד עם עלייה ב- BMI; עם זאת, לא ניתן לקבוע במחקר זה האם שינויים אלה היו קיימים מוקדם יותר בחיים או תוצאה של BMI גבוה יותר.
סביבה טרום לידתי: שני מחקרים שפורסמו לאחרונה עשו שימוש באוכלוסיות אנושיות שחוו שינויים "טבעיים" באספקת התזונה כדי לחקור את ההשפעה של תזונת האם לפני או במהלך ההריון על מתילציה של DNA אצל הצאצאים [68, 69]. במחקר הראשון נעשה שימוש בקבוצת אם-ילד בגמביה כדי להראות כי הן שינויים עונתיים בצריכת תורם מתיל מצד האם במהלך ההריון והן BMI לפני הריון מצד האם נקשרו למתילציה שונה אצל התינוקות [69]. המחקר השני השתמש בצאצאים בוגרים מקבוצת הרעב ההולנדי לחקר ההשפעה של חשיפה לפני הלידה לתקופה חריפה של תת תזונה אימהית קשה על מתילציה של DNA של גנים המעורבים בגדילה ובמטבוליזם בבגרות [68]. התוצאות הדגישו את החשיבות של עיתוי החשיפה בהשפעתה על האפיגנום, שכן השפעות אפיגנטיות משמעותיות זוהו רק אצל אנשים שנחשפו לרעב במהלך ההיריון המוקדם. חשוב לציין כי השינויים האפיגנטיים התרחשו יחד עם עלייה ב- BMI; עם זאת, לא ניתן לקבוע במחקר זה האם שינויים אלה היו קיימים מוקדם יותר בחיים או תוצאה של BMI גבוה יותר.
מחקרים אחרונים אחרים סיפקו עדויות לכך שתזונת יתר לפני הלידה וסביבה אימהית של השמנת יתר או סוכרתית קשורות גם לשינויים במתילציה של ה- DNA בגנים הקשורים להתפתחות עוברית, לצמיחה ולמחלות מטבוליות אצל הצאצאים [70 73].
בעוד נתונים אנושיים הם נדירים, יש סימנים לכך השמנה אביתית יכולה להוביל מתילציה שונה של גנים מוטבעים ב [74] התינוק, אפקט חשב להיות מתווך באמצעות שינויים epigenetic רכשה במהלך spermatogenesis.
 סביבה לאחר הלידה: האפיגנום הוקם דה נובו במהלך ההתפתחות העוברית, ולכן, סביר להניח שלסביבה טרום לידתי יש את ההשפעה המשמעותית ביותר על האפיגנום. עם זאת, כעת ברור כי אכן מתרחשים שינויים באפיגנום הבוגר בהשפעת מגוון מצבים, כולל הזדקנות, חשיפה לרעלים ושינויים תזונתיים. לדוגמא, הוכחו שינויים במתילציה של DNA במספר גנים בשרירי השלד וב- PGC1A ברקמת השומן כתגובה לדיאטה עתירת שומן [75, 76]. התערבויות לאיבוד מסת שומן בגוף נקשרו גם לשינויים במתילציה של ה- DNA. מחקרים דיווחו כי פרופילי מתילציה של ה- DNA של רקמת השומן [43, 64], תאים חד-גרעיניים חד-גרעיניים בדם [77] ורקמת השריר [78] בחולים שמנים בעבר הופכים דומים יותר לפרופילים של נבדקים רזים בעקבות ירידה במשקל. ניתוח לירידה במשקל גם הפך חלקית שינויים במתילציה שאינם אלכוהוליים של מחלות כבד שומניות הקשורות למחלות כבד [79] ובמחקר אחר הוביל להיפומתילציה של גנים מועמדים להשמנת יתר מרובה, עם השפעות בולטות יותר בתת עורית בהשוואה לשומן אומנטלי (קרבי) [64] . עדויות מצטברות מצביעות על כך שהתערבויות פעילות גופנית יכולות גם להשפיע על מתילציה של ה- DNA. מרבית המחקרים הללו נערכו באנשים רזים [80], אך מחקר אחד של תרגילים בקרב נבדקים T82DM שמנים הדגים גם שינויים במתילציה של ה- DNA, כולל בגנים המעורבים בהובלת חומצות שומן וגלוקוז [2]. שינויים אפיגנטיים מתרחשים גם עם ההזדקנות, ונתונים עדכניים מצביעים על תפקיד של השמנת יתר בהגברתם [83, 9, 84]. השמנת יתר האיצה את הגיל האפיגנטי של רקמת הכבד, אך בניגוד לממצאים שתוארו לעיל, השפעה זו לא הייתה הפיכה לאחר ירידה במשקל [85].
סביבה לאחר הלידה: האפיגנום הוקם דה נובו במהלך ההתפתחות העוברית, ולכן, סביר להניח שלסביבה טרום לידתי יש את ההשפעה המשמעותית ביותר על האפיגנום. עם זאת, כעת ברור כי אכן מתרחשים שינויים באפיגנום הבוגר בהשפעת מגוון מצבים, כולל הזדקנות, חשיפה לרעלים ושינויים תזונתיים. לדוגמא, הוכחו שינויים במתילציה של DNA במספר גנים בשרירי השלד וב- PGC1A ברקמת השומן כתגובה לדיאטה עתירת שומן [75, 76]. התערבויות לאיבוד מסת שומן בגוף נקשרו גם לשינויים במתילציה של ה- DNA. מחקרים דיווחו כי פרופילי מתילציה של ה- DNA של רקמת השומן [43, 64], תאים חד-גרעיניים חד-גרעיניים בדם [77] ורקמת השריר [78] בחולים שמנים בעבר הופכים דומים יותר לפרופילים של נבדקים רזים בעקבות ירידה במשקל. ניתוח לירידה במשקל גם הפך חלקית שינויים במתילציה שאינם אלכוהוליים של מחלות כבד שומניות הקשורות למחלות כבד [79] ובמחקר אחר הוביל להיפומתילציה של גנים מועמדים להשמנת יתר מרובה, עם השפעות בולטות יותר בתת עורית בהשוואה לשומן אומנטלי (קרבי) [64] . עדויות מצטברות מצביעות על כך שהתערבויות פעילות גופנית יכולות גם להשפיע על מתילציה של ה- DNA. מרבית המחקרים הללו נערכו באנשים רזים [80], אך מחקר אחד של תרגילים בקרב נבדקים T82DM שמנים הדגים גם שינויים במתילציה של ה- DNA, כולל בגנים המעורבים בהובלת חומצות שומן וגלוקוז [2]. שינויים אפיגנטיים מתרחשים גם עם ההזדקנות, ונתונים עדכניים מצביעים על תפקיד של השמנת יתר בהגברתם [83, 9, 84]. השמנת יתר האיצה את הגיל האפיגנטי של רקמת הכבד, אך בניגוד לממצאים שתוארו לעיל, השפעה זו לא הייתה הפיכה לאחר ירידה במשקל [85].
באופן קולקטיבי, הראיות התומכות ביכולת לבסס את האפיגנומה במבוגרים מעידים על כך שיש פוטנציאל להתערב בחיים שלאחר הלידה כדי לשנות או לשנות תכנות אפיגנטי שלילי.
אפקט גדלים והבדלים בין סוגי רקמות
![]() שינויים במתילציה של ה- DNA הקשורים להשמנה או הנגרמים על ידי התערבויות תזונה או אורח חיים וירידה במשקל הם בדרך כלל צנועים (<15%), אם כי זה משתנה בהתאם לפנוטיפ ולרקמה שנחקרה. למשל, דווחו על שינויים העולים על 20% ברקמת השומן לאחר ירידה במשקל [64] והקשרים בין מתילציה של HIF3A לבין BMI ברקמת השומן היו בולטים יותר מאשר בדם [52].
שינויים במתילציה של ה- DNA הקשורים להשמנה או הנגרמים על ידי התערבויות תזונה או אורח חיים וירידה במשקל הם בדרך כלל צנועים (<15%), אם כי זה משתנה בהתאם לפנוטיפ ולרקמה שנחקרה. למשל, דווחו על שינויים העולים על 20% ברקמת השומן לאחר ירידה במשקל [64] והקשרים בין מתילציה של HIF3A לבין BMI ברקמת השומן היו בולטים יותר מאשר בדם [52].
הרלוונטיות הביולוגית של שינויים מתילציה קטנים יחסית נחקרה. עם זאת, ברקמות המורכבות מתערובת של סוגי תאים, שינוי קטן במתילציה של הדנ"א עשוי למעשה לשקף שינוי משמעותי בשבר תא מסוים. שילוב של נתונים epigenome עם transcriptome ונתונים אפיגנטיים אחרים, כגון שינויים היסטון, הוא חשוב, שכן שינויים מתילציה DNA קטן עשוי לשקף שינויים גדולים יותר במבנה הכרומטין יכול להיות קשור לשינויים רחבים יותר ביטוי גנים. ההקשר הגנומי צריך גם להיחשב; שינויים קטנים בתוך אלמנט הרגולציה כגון promotor, משפר, או מבודדת עשויה להיות משמעות פונקציונלית. בהקשר זה, DMRs להשמנה, כמו גם אזורים המושפעים על ידי חשיפת רעב טרום לידתי mQTL עבור לוקוסים תכונה מטבולית נצפו כדי לחפות אלמנטים משפר [8, 43, 68]. קיימות עדויות לכך שמתילציה של דנ"א באזורים הקשורים לרעב אכן יכולה להשפיע על פעילות משפר [68], התומכת בתפקיד של שינויים במתילציה המושרה על ידי תזונה בגינון גנטי.
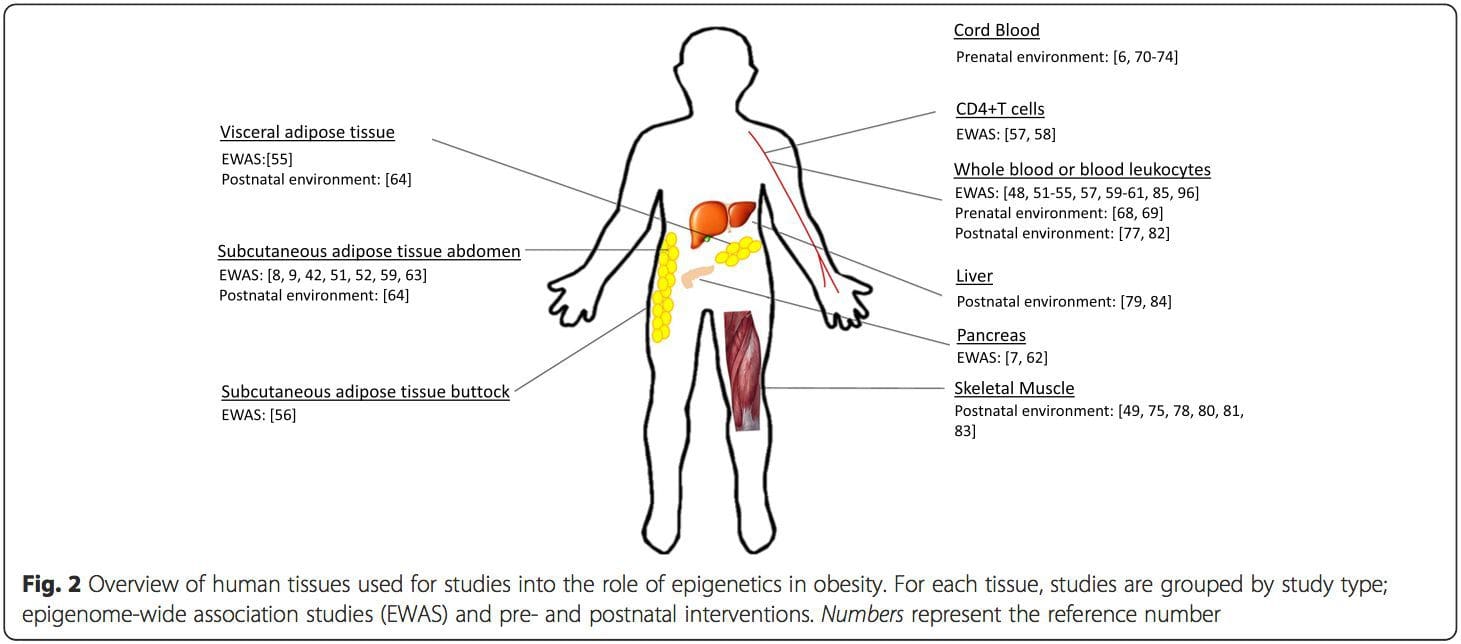
מגבלה עיקרית במחקרים רבים בבני אדם היא שסימנים אפיגנטיים מוערכים לעתים קרובות בדם היקפי, ולא ברקמות רלוונטיות מטבולית (איור 2). ההטרוגניות של הדם היא בעיה, מכיוון שאוכלוסיות תאים שונות חותמות אפיגנטיות מובהקות, אך אלגוריתמים פותחו כדי לאמוד את הרכב הסלולר בכדי להתגבר על בעיה זו [86]. אולי יותר חשוב מכך, סימנים אפיגנטיים בתאי הדם עשויים לא בהכרח לדווח על מצב הרקמות בעלות העניין העיקרי. למרות זאת, מחקרים אחרונים סיפקו עדויות ברורות לקשר בין סימנים אפיגנטיים בתאי הדם לבין ה- BMI. במקרה של HIF3A שרמת המתילציה שלו (ערך בטא) באוכלוסיית המחקר נעה בין 0.14 0.52, עלייה של 10% במתילציה נקשרה לעלייה ב- BMI של 7.8% [52]. כמו כן, הבדל של 10% במתילציה של PGC1A עשוי לחזות עד 12% הבדל במסת השומן [54].
 מסקנות
מסקנות
המחקר על תפקידה של אפיגנטיקה בהשמנה ובמחלות מטבוליות התרחב במהירות בשנים האחרונות, וראיות מצטברות של קשר בין שינויים אפיגנטיים לתוצאות בריאותיות מטבוליות בבני אדם. סמנים ביולוגיים אפשריים הקשורים בהשמנה ובריאות מטבולית התפתחו גם ממחקרים שנערכו לאחרונה. האימות של סימנים אפיגנטיים במספר רב של קבוצות, העובדה כי מספר סימנים נמצאים בגנים עם פונקציה סבירה בהשמנת יתר ופיתוח T2DM, כמו גם חפיפה של סימנים אפיגנטיים עם השמנה ידוע TXIUMXDM לוקוסים גנטיים מחזק את הראיות כי האסוציאציות האלה הם אמיתי. עד כה קשה היה לבסס סיבתיות; עם זאת, בין אם האסוציאציות הן סיבתיות, הסימנים האפיגנטיים שזוהו עשויים להיות רלוונטיים כסימנים ביולוגיים השמנה וסיכון למחלות מטבוליות.
גדלי ההשפעות ברקמות הנגישות בקלות כמו דם הם קטנים אך נראים לשחזור למרות השונות במוצא אתני, סוג הרקמה ושיטות הניתוח [51]. כמו כן, גם לשינויים קטנים במתילציה של ה- DNA עשויה להיות משמעות ביולוגית. גישה "אינטימית" אינטגרטיבית תהיה מכריעה בפירוט נוסף של האינטראקציות המורכבות בין האפיגנום, התעתיק, הגנום והבריאות המטבולית. מחקרים אורכיים, המשתרעים באופן אידיאלי על דורות מרובים, הם חיוניים לביסוס קשרים סיבתיים. אנו יכולים לצפות לעוד מחקרים כאלה בעתיד, אך זה ייקח זמן.
בעוד מחקרים בבעלי חיים ממשיכים להפגין השפעה של החיים המוקדמים תזונתי חשיפה לאפיגנום ולבריאות המטבולית של הצאצאים, הנתונים האנושיים עדיין מוגבלים. עם זאת, מחקרים אחרונים סיפקו ראיות ברורות כי חשיפה לתזונה תת אופטימלית בתקופות ספציפיות של התפתחות טרום לידתי קשורה לשינויים במתילציה אצל הצאצאים ולכן יש להם פוטנציאל להשפיע על פנוטיפ של מבוגרים. מחקרים בבעלי חיים יהיו חשובים כדי לאמת את הממצאים בבני אדם בסביבה מבוקרת יותר, לסייע לקבוע אם לשינויים המתילציה שזוהו יש השפעה כלשהי על הבריאות המטבולית, ולפרום את המנגנונים העומדים בבסיס ויסות אפיגנטיות בין דוריות / דוריות. זיהוי המנגנונים הסיבתיים העומדים בבסיס תגובות הזיכרון המטבוליות, אופן העברת ההשפעות הפנוטיפיות לדורות עוקבים, מידת ההשפעה והיציבות של התכונה המועברת, וזיהוי הקשר אבולוציוני כולל ומאחד, נותרו גם כן שאלות חשובות שיש להתייחס אליהן. . זה האחרון נסתם לעיתים קרובות על ידי השערת התגובה ההסתגלותית המנבאית, כלומר תגובה לסביבה צפויה בעתיד המגבירה את כושר האוכלוסייה. עם זאת, השערה זו הוטלה בספק יותר ויותר מכיוון שישנן עדויות מוגבלות לכושר מוגבר בהמשך החיים [87].
לסיכום, התוצאות הן מבטיחות, שכן השינויים האפיגנטיים קשורים לבריאות המטבולית של המבוגרים, והם פועלים כמגשרים בין תזונה טרום לידתית לבין סיכון מוגבר לתוצאות בריאותיות מטבוליות ירודות. סימני אפיגנטיקה חדשים זוהו כי הם קשורים עם אמצעים של בריאות מטבולית. שילוב של שכבות שונות של מידע גנומי הוסיפה תמיכה נוספת למערכות יחסים סיבתיות, והיו מחקרים נוספים המראים השפעות של סביבה לפני ואחרי על אפיגנום ובריאות. בעוד ששאלות רבות נותרו בעינה, ההתקדמות המתודולוגית האחרונה אפשרה את סוגי המחקרים המבוססים על אוכלוסיות בקנה מידה גדול, אשר יידרשו להתמודד עם פערי הידע. העשור הבא מבטיח להיות תקופה של פעילות מרכזית בתחום המחקר החשוב הזה.
Susan J. van Dijk1, Ross L. Tellam2, Janna L. Morrison3, Beverly S. Muhlhausler 4,5 and Peter L. Molloy1 *
אינטרסים מתחרים
המחברים מצהירים כי אין להם אינטרסים מתחרים.
תרומות מחברים
כל המחברים תרמו לניסוח ולביצוע הביקורת של כתב היד, וכל המחברים קראו ואישרו את כתב היד הסופי.
מידע על מחברים
בוורלי ס 'Muhlhausler ופיטר L. Molloy הם סופרים משותפים האחרון.
תודות
עבודה זו נתמכה על ידי מענק מקרן ההקדשים למדע ולתעשייה (גרנט RP03-064). JLM ו BSM נתמכים על ידי המועצה הלאומית לבריאות רפואי מחקר המועצה קריירה מלגות (JLM, APP1066916, BSM, APP1004211). אנו מודים לאנס Macaulay ו סו מיטשל לקריאה ביקורתית הערות על כתב היד.
פרטי המחבר
1CSIRO ספינת מזון ותזונה, תיבת דואר 52, צפון רייד, NSW 1670, אוסטרליה. ספינת הדגל החקלאית 2CSIRO, כרמודי כביש 306, סנט לוסיה, QLD 4067, אוסטרליה. 3 מקורות מוקדמים של קבוצת המחקר לבריאות מבוגרים, בית הספר לרוקחות ומדעי הרפואה, מכון סנסום למחקר בריאות, אוניברסיטת דרום אוסטרליה, ת"ת 2471, אדלייד, ס"א 5001, אוסטרליה. 4, גלן אוסמונד, SA 1, אוסטרליה. 5064 מכון לחקר הבריאות לנשים וילדים, 5 קינג וויליאם רואד, צפון אדלייד, SA 72, אוסטרליה.
רֵיק
הפניות:
1. מי. מי | עודף משקל והשמנה. www.who.int/gho/ncd/
עודף משקל / en / index.html. נכנס ל- 29 בינואר 2015.
2. Visscher PM, Brown MA, McCarthy MI, Yang J. חמש שנים של גילוי GWAS.
Am J Hum Genet. 2012; 90: 7 24.
3. לוק AE, Kahali B, ברנדט SI, AE המשפטים, פרס TH, יום FR, et al. גֵנֵטִי
מחקרים של מדד מסת הגוף מייצרים תובנות חדשות לביולוגיה של השמנת יתר. טֶבַע.
2015, 518: 197 206.
4. Ling C, Del Guerra S, Lupi R, R nn T, Granhall C, Luthman H, et al.
תקנה אפיגנטית של PPARGC1A בסוג האדם 2 סכרת הסוכר
השפעה על הפרשת האינסולין. דיאבטולוגיה. 2008; 51: 615 22.
5. ואן Dijk SJ, Molloy PL, Varinli H, מוריסון JL, Muhlhausler BS. אפיגנטיקה
והשמנה אנושית. אינט ג'יי אובס (לונד). 2015; 39: 85 97.
6. אל, פאן ח, חן L, אונג ML, Dogra S, וונג J, et al. האפקט של
גנוטיפ בסביבה של הרחם על וריאציה בין אינדיבידואלית בילוד
מתילומי DNA. Genome Res. 2014; 24: 1064 74.
7. אולסון אה, וולקוב P, Bacos K, Dayeh T, הול E, Nilsson EA, et al. Genomewide
קשרים בין השפעת וריאציה גנטית ואפיגנטית
ביטוי mRNA והפרשת האינסולין של איברים הלבלב האנושי. פלוס
ג 'אנט. 2014; 10: e1004735.
8. גרונדברג E, מדורי E, Sandling JK, הדמן AK, Keildson S, Buil A, et al.
ניתוח גלובלי של וריאציה מתילציה דנ"א ברקמת השומן מתאומים
חושף קישורים לגרסאות הקשורות למחלות באלמנטים רגולטוריים מרוחקים.
Am J Hum Genet. 2013; 93: 876 90.
9. רון ט, וולקוב פ ', גילברג L, קוקוסאר ז, פרפייליב א', ג'ייקובסן אל, ואחרים.
השפעת הגיל, רמות BMI ו- HbA1c על הדנ"א רחב הגנום
מתילציה דפוסי ביטוי mRNA ברקמת השומן האנושי
וזיהוי סמנים ביולוגיים אפיגנטיים בדם. הומול מול.
2015, 24: 3792 813.
10. Waterland RA, מיכלס KB. אפידמיולוגיה אפיגנטית של ההתפתחות
השערת מקורות. Annu Rev Nutr. 2007, 27: 363 88.
11. מקמילן IC, Rattanatray L, Duffield JA, מוריסון JL, MacLaughlin SM, Gentili
S, et al. המוצא המוקדם של השמנת יתר מאוחר יותר: מסלולים ומנגנונים. עו"ד
Exp Med Biol. 2009, 646: 71 81.
12. ראוולי א, ואן דר מיולן, מישל ר, אוסמונד ג, בארקר ד, Hales C, et al.
גלוקוז סובלנות אצל מבוגרים לאחר חשיפה טרום לידתי לרעב. אִזְמֵל.
1998, 351: 173 7.
13. מקמילן IC, MacLaughlin SM, Muhlhausler BS, Gentili S, Duffield JL,
מוריסון ג 'ל. מקורות התפתחותיים של בריאות ומחלות לבוגרים: תפקידו של
תזונתית ועוברית. יסוד פרמקול טוקסיקול.
2008, 102: 82 9.
14. ג'אנג S, Rattanatray L, מקמילן IC, Suter CM, מוריסון JL. פריקונספציונלי
תזונה ותכנות מוקדם של חיים של השמנה או מצוקה. Prog
ביופיס מול ביול. 2011, 106: 307 14.
15. ב ', לוין בי, אוזן SE. יחסי גומלין בין גנים לסביבה
אנרגיה גלוקוז הומאוסטזיס ואת מקורות התפתחותיים של השמנת יתר.
Physiol Rev. 2015; 95: 47 82.
16. Borengasser SJ, Zhong Y, Kang P, Lindsey F, רוניס MJ, Badger TM, et al.
השמנת יתר אימהית משפר הבדל רקמות השומן לבן משנה
גנום בקנה מידה מתילציה דנ"א ב זכר חולדה צאצאים. אנדוקרינולוגיה.
2013, 154: 4113 25.
17. גלוקמן PD, Lillycrop KA, ויקרס MH, Pleasants AB, פיליפס ES, Beedle AS,
et al. פלסטיות מטבולית במהלך התפתחות יונקים היא כיוונית
תלוי במצב התזונתי המוקדם. Proc Natl Acad Sci ארה"ב א.
2007, 104: 12796 800.
18. גודפרי KM, שפרד א, גלקמן PD, Lillycrop KA, נטל GC, מקלין C,
et al. מתמטיקאי מקדם גנטי epigenetic בלידה קשורה
שומן מאוחר יותר של הילד. סוכרת. 2011; 60: 1528 34.
19. מקמילן IC, אדם CL, Muhlhausler BS. מקורות מוקדמים של השמנת יתר:
תכנות מערכת הרגולציה בתיאבון. J Physiol. 2005; 565 (נק '1): 9 17.
20. Begum G, סטיבנס A, סמית EB, קונור K, Challis JR, בלומפילד F, et al.
שינויים אפיגנטיים באנרגיית ההיפותלמוס בעובר
הקשורים לתת תזונה תת-ימית ותאומות. FASEB J.
2012, 26: 1694 703.
21. Ge ZJ, ליאנג QX, Hou Y, האן ZM, Schatten H, Sun QY, et al. השמנת יתר מצד האם
וסוכרת עלולה לגרום לשינוי מתילציה של דנ"א בזרעונים של
צאצאים בעכברים. רפרוד ביאול אנדוקרינול. 2014; 12: 29.
22. Jousse C, Parry L, למברט Langlais S, מאורין AC, Averous J, Bruhat A, et al.
תת תזונה תת-מחלתית משפיעה על המתילציה ועל הביטוי של הלפטין
גן במבוגרים: משמעויות להבנת תסמונת מטבולית.
FASEB J. 2011; 25: 3271 8.
23. לאן X, Cretney EC, Kropp J, Khateeb K, ברג MA, Penagaricano F, et al.
דיאטה האם במהלך ההריון גורם ביטוי גנים DNA
מתילציה שינויים ברקמות העובר בכבשים. ג 'ינט הקדמי. 2013; 4: 49.
24. לי CC, Young PE, Maloney CA, איטון SA, Cowley MJ, Buckland ME, et al.
השמנת יתר האם וסוכרת גורמת ליקויים מטבוליים סמויים
שינויים אפיגנטיים נרחבים בעכברים איזוגניים. אפיגנטיקה. 2013; 8: 602 11.
25. Lillycrop KA, פיליפס ES, ג 'קסון AA, הנסון MA, בורד GC. חלבון תזונתי
הגבלה של חולדות בהריון גורם תוסף חומצה פולית מונע
שינוי אפיגנטי של ביטוי גנטי בכבד אצל הצאצא. J Nutr.
2005, 135: 1382 6.
26. רדפורד EJ, איטו M, שי H, קוריאש JA, יאמאזאווה K, Isganaitis E, et al. ברחם
ההשפעות. בתת-תזונה של הרחם מטריד את הזרע הבוגר methylome
ו מטבוליזם בין דורית. מַדָע. 2014; 345 (80): 1255903.
27. Suter M, Bocock P, Showalter L, הו M, Shope C, McKnight R, et al.
אפיגנומיקה: החשיפה לתזונה עשירה בשומן בדם
היקפי ביטוי הגן היקפי ב פרימאטים לא אנושיים. FASEB J.
2011, 25: 714 26.
28. סוטר מא, מא, J, Vuguin PM, Hartil K, Fiallo A, האריס RA, et al. ברחם
חשיפה לדיאטה אימהית בשומן גבוה משנה את קוד ההיסטון epigenetic ב
מודל עכברי. Am J Obs Gynecol. 2014; 210: 463 e1 463 e11.
29. טוש DN, פו ש, Callaway CW, McKnight RA, מקמילן IC, רוס MG, et al.
אפיגנטיקה של השמנה מתוכנת: שינוי IGR הכבד IGF1 הכבד
ביטוי mRNA ומבנה היסטון במהירות מול עיכוב שלאחר הלידה
צמיחת צמיחה. האם פיסיול גסטרוטינט כבד פיזיול.
2010; 299: G1023 9.
30. Sandovici אני, סמית NH, Nitert MD, אקרס ג 'ונסון M, Uribe-Lewis S, Ito Y,
et al. דיאטה האם ו ההזדקנות לשנות את השליטה epigenetic של promoterenhancer
אינטראקציה בגן Hnf4a ב איברים הלבלב חולדה. Proc Natl
Acad Sci US A. 2011; 108: 5449 54.
31. בראונשוויג מ ', ג' ונתן V, גצווילר, דבורה ג 'חקירות על
תגובה epigetic transgenerational למטה את שורת זכר חזירים F2. פלוס
אחד. 2012; 7, e30583.
32. Carone BR, Fauquier L, Habib N, Shea JM, הארט לסה"נ, Li R, et al. אבהי
המושרה הסביבה תכנות מחדש סביבתי transgenerational של מטבולית
ביטוי גנים אצל יונקים. תָא. 2010, 143: 1084 96.
33. אוסט A, Lempradl A, Casas E, Weigert M, Tiko T, Deniz M, et al. דיאטה אבהית
מגדיר מצב הכרומטין צאצא והשמנה בין דורית. תָא.
2014, 159: 1352 64.
34. מרטנז D, Pentinat T, Rib S, Daviaud C, Bloks VW, Cebri J, et al. ברחם
תת תזונה של עכברים תוכניות הכבד השומן מטבוליזם ב secondgeneration
צאצא של מתילציה של דנ"א Lxra השתנה. תא מטב.
2014, 19: 941 51.
35. Wei Y, יאנג CR, Wei YP, Zhao ZA, Hou Y, Schatten H, et al. אבהי
גרמה תורשת transgenerational של רגישות לסוכרת ב
יונקים. Proc Natl Acad Sci US A. 2014; 111: 1873 8.
36. גרוסניקלאוס U, קלי WG, קלי B, Ferguson-Smith AC, פמבריי M, Lindquist
ס ירושה epigetic transgenerational: כמה זה חשוב? נט Rev
ג'נט. 2013; 14: 228 35.
37. Pembrey M, סאפרי R, Bygren LO. תגובות אנושיות טרנסג'נציאליות ל
ניסיון מוקדם בחיים: השפעה אפשרית על התפתחות, בריאות ו
מחקר ביו-רפואי. J Med Genet. 2014; 51: 563 72.
38. Wolff GL, Kodell RL, מור SR, קוני CA. אפיגנטיקה מתילית ומתיל
ספקים משפיעים על ביטוי גנטי agouti ב אבי / עכברים. FASEB J.
1998, 12: 949 57.
39. Jirtle RL, סקינר ח"כ. אפיגנומיקה סביבתית ורגישות למחלות.
נט Rev Genet. 2007; 8: 253 62.
40. מורגן HD, סאתרלנד HG, מרטין DI, Whitelaw E. הירושה epigenetic ב
לוקוס האגוטי בעכבר. נט ג'נט. 1999; 23: 314 8.
41. קרופלי ג'יי, סוטר סי.אם, בקמן ק.ב., מרטין די. גרמיקת קו אפיגנטי
שינוי של אלן V Murin על ידי תוספת תזונתיים. מעבד
Natl Acad Sci US A. 2006; 103: 17308 12.
42. Hile SP, Lillycrop KA, תומאס NA, הנסון MA, נטל GC. חלבון תזונתי
הגבלה בזמן הריון F0 אצל חולדות גורמת לשינויים בין דוריים
את transcriptome hepatic אצל הצאצאים. PLoS ONE. 2011; 6, e21668.
43. Multhaup ML, Seldin MM, JAE AE, Lei X, Kirchner H, Mondal P, et al. עכבר
ניתוח ניסיוני אפיגנטי מסכות מטרות תזונתיות ו
אחריות גנטית לפנוטיפים סוכרתיים. תא מטא. 2015; 21: 138 49.
44. מיכלס KB, בינדר AM, Dedeurwaerder S, אפשטיין CB, Greally JM, Gut I, et al.
המלצות לתכנון וניתוח של epigenome-wide
לימודי אגודה. שיטות נט. 2013; 10: 949 55.
45. Dayeh TA, Olsson AH, Volkov P, Almgren P, R nn T, Ling C. זיהוי של
CpG-SNPs הקשורים לסוכרת מסוג 2 ומתילציה של דנ"א דיפרנציאלי
באיי לבלב אנושיים. דיאבטולוגיה. 2013; 56: 1036 46.
46. רלטון CL, דייווי סמית 'ר רנדומיזציה מנדלית אפיגנטית דו - שלבית: א
אסטרטגיה לבניית התפקיד הסיבתי של תהליכים אפיגנטיים במסלולים
למחלה. Int J אפידמיול. 2012; 41: 161 76.
47. Liu Y, Aryee MJ, Padyukov L, Fallin MD, Hesselberg E, Runarsson A, et al.
נתוני ההתאגדות של Epigenome מקיפים מתילציה של DNA כ
מתווך הסיכון הגנטי בדלקת מפרקים שגרונית. נט ביוטכנולוגיה.
2013, 31: 142 7.
48. יואן W, שיה Y, Bell CG, אבל אני, Ferreira T, וורד KJ, et al. משולבת
אנליזה epigenomic עבור סוג 2 סוכרת רגישות loci ב monozygotic
תְאוּמִים. קהילת Nat. 2014; 5: 5719.
49. Nitert MD, Dayeh T, Volkov P, Elgzyri T, הול E, Nilsson E, et al. השפעת א
התערבות תרגיל על מתילציה דנ"א בשרירי השלד מן firstdegree
קרובי משפחה של חולים עם סוכרת מסוג 2. סוכרת. 2012; 61: 3322 32.
50. Gagnon F, A ssi D, Carri A, Morange PE, Tr gou t DA. אימות חזק של
מתילציה רמות הקשר ב לוקוס CPT1A עם רמות פלסמה שומנים.
J Lipid Res. 2014, 55: 1189 91.
51. Demerath EW, גואן W, Grove ML, Aslibekyan S, מנדלסון M, ג 'ואו YH,
et al. Epigenome רחב האגודה atudy (EWAS) של BMI, שינוי BMI, ו
היקף המותניים אצל מבוגרים אפרו-אמריקנים מזהה מספר רב של משוכפלים
לוקוסים. הום מול גנט. 2015: ddv161 .
52. דיק קי ג'יי, נלסון CP, Tsaprouni L, Sandling JK, A ssi D, Wahl S, et al. DNA
מתילציה ומדד מסת הגוף: ניתוח גנומי רחב. אִזְמֵל.
2014, 6736: 1 9.
53. סו S, Zhu H, X X, וואנג X, דונג Y, Kapuku G, et al. מתילציה של דנ"א
הגן LY86 קשור להשמנה, עמידות לאינסולין ו
דַלֶקֶת. תאום Res Hum Genet. 2014; 17: 183 91.
54. Clarke-Harris R, Wilkin TJ, Hosking J, פינקני J, Jeffery AN, Metcalf BS, et al.
PGC1? מתילציה של היזם בדם בגיל 5 7 שנים מנבא שומן מ
9 עד 14 שנים (EarlyBird 50). סוכרת. 2014; 63: 2528 37.
55. Guay SP, Brisson D, Lamarche B, Biron S, Lescelleur O, Biertho L, et al.
ADRB3 מקדם דנ"א מתילציה בדם ושומן שומני
רקמה קשורה להפרעות מטבוליות אצל גברים. אפיגנומיקה.
2014, 6: 33 43.
56. Agha G, Houseman EA, Kelsey KT, איטון CB, Buka SL, Lucks EB. השמנה היא
הקשורים פרופיל מתילציה DNA ברקמת השומן. Int J אפידמיול.
2014: 1 11.
57. אירווין MR, Zhi D, ג'והנס R, מנדלסון M, Aslibekyan S, קלאס SA, et al.
מחקר של אגניגנום רחב של שומנים בדם בצום בגנטיקה של
תרופות להורדת שומנים בדם ומחקר רשת דיאטה. מחזור. 2014; 130: 565 72.
58. Frazier-Wood AC, Aslibekyan S, אבשר DM, הופקינס PN, Sha J, Tsai My, et al.
מתילציה ב לוקוס CPT1A קשורה עם subfraction lipoprotein
פרופילים. J Lipid Res. 2014, 55: 1324 30.
59. Pfeifferm L, Wahl S, Pilling LC, Reischl E, Sandling JK, Kunze S, et al. דנ"א
מתילציה של גנים הקשורים ליפידים משפיעה על רמות שומנים בדם. מעגל קרדיובסק
ג 'אנט. 2015.
60. פטרסן א.ק., זיילינגר S, קסטנמולר G, רמיש-מרגל W, ברוג'ר M, פיטרס
A, et al. אפיגנטיקה פוגשת מטבולומיה: אסוציאציה רחבה
מחקר עם תכונות מטבוליות בסרום בדם. הום מול גנט. 2014; 23: 534 45.
61. Hidalgo B, Irvin MR, Sha J, Zhi D, Aslibekyan S, אבשר D, et al. Epigenomewide
מחקר של צום אמצעים של גלוקוז, אינסולין, ו- HOMA-IR
בגנטיקה של תרופות להורדת שומנים ודיאטה. סוכרת.
2014, 63: 801 7.
62. Dayeh T, Volkov P, Sal S, Hall E, Nilsson E, Olsson AH, et al. כל הגנום
ניתוח מתילציה דנ"א של איברים הלבלב האנושי מסוג 2 סוכרת
ו התורמים שאינם סוכרת מזהה גנים מועמדים המשפיעים על אינסולין
הַפרָשָׁה. פלוס. 2014; 10, e1004160.
63. Nilsson E, Jansson PA, Perfilyev A, Volkov P, Pedersen M, Svensson MK, et al.
מתילציה דנ"א השתנה ביטוי דיפרנציאלי של הגנים המשפיעים
מטבוליזם דלקת ברקמת השומן של נושאים עם סוג 2
סוכרת. סוכרת. 2014, 63: 2962 76.
64. בנטון MC, ג 'ונסטון, אקלס D, הרמון B, הייז MT, לאה RA, et al. ניתוח של מתילציה דנ"א ברקמת השומן האנושי מגלה שינוי דיפרנציאלי של גנים השמנה לפני ואחרי מעקף קיבה ומשקל
הֶפסֵד. גֵן. 2015; 16: 1 21.
65. בייטסון P, גלוקמן פ פלסטיניות וחוסן בפיתוח ו
אבולוציה. Int J אפידמיול. 2012, 41: 219 23.
66. פיינברג AP, Irizarry RA, פיינברג AP, Irizarry RA. אבולוציה בבריאות
רפואה Sackler קולוקוויום: וריאציה epigenetic סטוכסטי כנהיגה
כוח ההתפתחות, ההתאמה האבולוציונית ומחלות. Proc Natl אכד
Sci US A. 2010; 107 (ספק): 1757 64.
67. מרטינו D, Loke YJ, גורדון L, Ollikainen M, Cruickshank MN, Saffery R, et al.
ניתוח אורך, גנום בקנה מידה של מתילציה דנ"א תאומים מלידה
ל 18 חודשים של גיל מגלה שינוי אפיגנטי מהיר בחיים המוקדמים ו pairspecific
השפעות של חוסר התאמה. גנום ביול. 2013; 14: R42.
68. טובי EW, ג 'יימן JJ, Monajemi R, ג' ח, פוטר H, ג 'אנג Y, et al. דנ"א
מתילציה החתיכות קשר רעב טרום לידתי חשיפה לצמיחה
חילוף חומרים. קהילת Nat. 2014; 5: 5592.
69. Dominguez-Salas P, מור SE, בייקר MS, ברגן AW, Cox SE, Dyer RA, et al.
תזונה אימהית בתפיסה מאופיינת מתילציה של דנ"א של האדם
הגרעיני metastable. קהילת Nat. 2014; 5: 3746.
70. Quilter CR, קופר WN, צוק KM, סקינר BM, Prentice PM, נלסון L, et al.
השפעה על דפוסי מתילציה של צאצאים של סוכרת הריון אימהית
mititus ו intrauterine ריסון הצמיחה מציע גנים נפוצים ו
מסלולים הקשורים לסיכון לסוכרת מסוג 2 שלאחר מכן. FASEB J. 2014: 1 12.
71. Morales E, Groom A, Lawlor DA, רלטון CL. מתילציה דנ"א חתימות ב
דם טבורי הקשור עם עלייה במשקל האימהי האימהי: תוצאות מ
קבוצת ALSPAC. הערות BMC. 2014; 7: 278.
72. Ruchat SM, Houde AA, Voisin G, St-Pierre J, Perron P, Baillargeon JP, et al.
סוכרת הריונית משפיעה באופן אפיגני על הגנים בעיקר
מעורב במחלות מטבוליות. אפיגנטיקה. 2013; 8: 935 43.
73. ליו X, חן Q, Tsai HJ, וואנג G, הונג X, ג'ואו Y, et al. אִמָהִי
preconception הגוף מסת אינדקס דנ"א דם טבורי דם
מתילציה: חקר מקורות חיים מוקדמים של המחלה. Environ Mol
מוטגן. 2014; 55: 223 30.
74. Soubry A, מרפי SK, וואנג F, Huang Z, Vidal AC, Fuemmeler BF, et al.
יילודים של הורים שמנים שינו דפוסי מתילציה דנ"א ב
גנים מוטבעים. אינט ג'יי אובס (לונד). 2015; 39: 650 7.
75. Jacobsen SC, Browns C, Bork-Jensen J, Ribel-Madsen R, Yang B, Lara E, et al.
ההשפעות של overfeeding לטווח קצר על שומן על גנום רחב DNA
מתילציה בשרירי השלד של צעירים בריאים. Diabetologia.
2012, 55: 3341 9.
76. גילברג ל ', ג'ייקובסן SC, רון ט', ברנס ג ', ואג א' PPARGC1A DNA
מתילציה ברקמת השומן התת עורית אצל נבדקים במשקל לידה נמוך
השפעה של 5 ימים של הזנת יתר בשומן. חילוף חומרים. 2014, 63: 263 71.
77. הואנג YT, Maccani JZJ, Hawley NL, אגף RR, Kelsey KT, McCaffery JM.
דפוסים אפיגנטיים במובילי הרזיה מוצלחים: מחקר פיילוט. Int J
אובס (לונד). 2015; 39: 865 8.
78. Barres R, Kirchner H, Rasmussen M, Yan J, Kantor FR, Krook A, N slund E,
Zierath JR. ירידה במשקל לאחר ניתוח מעקף קיבה בשמנת האדם
משפץ מתילציה של היזם. נציג תאים .2013: 1 8.
79. Ahrens M, Ammerpohl O, von Schönfels W, Kolarova J, Bens S, Itzel T, et al.
ניתוח מתילציה DNA במחלת כבד שומני לא אלכוהוליים מציע
חתימות ספציפיות למחלות ולשיפוץ לאחר ניתוח בריאטרי.
תא מטא. 2013; 18: 296 302.
80. Voisin S, Eynon N, יאן X, הבישוף DJ. תרגיל אימון מתילציה דנ"א
בבני אדם. אקטה פיסיול (Oxf). 2014, 213: 39.
81. Lindholm ME, Marabita F, Gomez-Cabrero D, Rundqvist H, Ekström TJ,
Tegn r J, et al. ניתוח אינטגרטיבי חושף תכנות מחדש מתואם
של epigenome ו transcriptome בשרירי השלד האנושי לאחר
הַדְרָכָה. אפיגנטיקה. 2014, 9: 1557 69.
82. דנהאם ג'יי, אובריאן בי ג'יי, מרקס FZ, צ'ארצ'ר פי. שינויים בלוקוציט
methylome והשפעתה על גנים הקשורים לב וכלי הדם לאחר התרגיל.
J Appli Physiol. 2014: jap.00878.2014.
83. Rowlands DS, דף RA, Sukala WR, Giri M, Ghimbovschi SD, Hayat אני, et al.
Multi-Omic רשתות משולבות להתחבר מתילציה דנ"א מירנה עם
שלפוחיות שריר השלד לתרגול כרוני מסוג 2 השמנת יתר סוכרתית.
גנומיקה של פיזיול. 2014; 46: 747 65.
84. הורבאט, ארהארט ו ', ברוש ז, אממרפוול, פון שונפלס, אהרנס מ,
et al. השמנת יתר מאיצה הזדקנות epigenetic של הכבד האנושי. Proc Natl אכד
Sci. 2014; 111: 15538 43.
85. Alm n MS, Nilsson EK, Jacobsson JA, Kalnina I, Klovins J, Fredriksson R, et al.
ניתוח גנום רחב מגלה מתילציה דנ"א סמנים המשתנים עם
גם גיל וגם השמנה. גֵן. 2014.; 548: 61 7
86. האוסמן EA, Molitor J, מרסיט CJ. הפניה ללא התאמות תערובת התא
בניתוח נתוני מתילציה של DNA. ביואינפורמטיקה. 2014; 30: 1431 9.
87. וולס ג'יי סי. הערכה קריטית של השערת התגובה ההסתגלותית (Adiveive adaptive Response hypothesis).
Int J אפידמיול. 2012; 41: 229 35.
88. וויליאמס- Wyss O, ג 'אנג S, MacLaughlin SM, קלימן D, ווקר SK, Suter
CM, et al. מספר העובר ותת-תזונה periconceptional ב
כבשים יש השפעות דיפרנציאליות על אפיגנוטיפ adrenal, צמיחה, ו
התפתחות. Am J Physiol Endocrinol Metab. 2014; 307: E141 50.
89. ג'אנג S, Rattanatray L, מוריסון JL, ניקולס LM, שקר S, מקמילן IC.
השמנת-יתר של האם והמקורות הראשונים של השמנה בילדות: שקילה
את היתרונות והעלויות של איבוד משקל אימהי ב periconceptional
תקופה עבור הצאצאים. Exp Diabetes Res. 2011; 2011: 585749.
90. ג 'אנג S, וויליאמס, Wyss O, MacLaughlin SM, ווקר SK, קלימן DO, Suter
CM, et al. תת תזונה תת-אימהית בשבוע הראשון שלאחר ההתעברות
תוצאות הביטוי ירד של mRNA קולטן glucocorticoid ב
היעדר GR אקסון 17 hypermethylation של יותרת המוח בעובר מאוחר
הֵרָיוֹן. J Dev Orig Heal Dis. 2013; 4: 391 401.
91. שקר S, מוריסון JL, וויליאמס, Wyss O, Suter CM, Humphreys DT, Ozanne SE,
et al. Priconceptional תת תזונה תזונתיים שינויים באינסולין- signaling
מולקולות ומיקרו-רנ"א בשרירי השלד בסינגלטון ובתאומים תאומים
כבשים. Biol Reprod. 2014; 90: 5.
92. ואן סטראטן EM, van Meer H, Huijkman NC, ואן Dijk TH, באלר JF, Verkade
HJ, et al. העובר הכבד X הפעלת קולטן acutely גורם lipogenesis אבל
אינו משפיע על תגובת שומנים בדם לתזונה עשירה בשומן בעכברים בוגרים. Am J
פיסיול אנדוקרינול מטאב. 2009; 297: E1171 8.
93. פרננדז-טווין ד.ש., אלפאךדי MZ, מרטין-גרונרט MS, Duque-Guimaraes
DE, Piekarz A, Ferland-McCollough D, et al. Downregulation של IRS-1 ב
רקמת שומן של צאצא של עכברים שמנים מתוכנתת בצורה תאית
באמצעות מנגנוני פוסט-תעתיק. Mol Metab.
2014, 3: 325 33.
94. Waterland RA, Travisano M, Tahiliani KG. דיאט- Induced hypermethlation ב
agouti קיימא צהוב אינו עובר בירושה transgenerationally דרך הנקבה.
FASEB J. 2007; 21: 3380 5.
95. Ge ZJ, Luo SM, לין F, ליאנג QX, Huang L, Wei YC, et al. מתילציה של דנ"א ב
ביציות וכבד של עכברים נקביים וצאצאיהם: השפעות של דיאטה עתירת שומן
הַשׁמָנָה. נקודת מבט לרפא Env. 2014; 122: 159 64.
96. Ollikainen M, Ismail K, Gervin K, Kyll nen A, Hakkarainen A, Lundbom J, et al.
שינויים במתילציה של דנ"א בדם בגנום בגורמים רגולטוריים
אזורים heterochromatic ב תאומים monozygotic מתנגדים להשמנה
ושומן בכבד. אפיגנטיקה קלינית. 2015; 7: 1 13.
סגור אקורדיון
המידע כאן בנושא "תפקידה של אפיגנטיקה בהשמנה ומחלות מטבוליות" אינו מיועד להחליף מערכת יחסים אחד על אחד עם איש מקצוע מוסמך בתחום הבריאות או רופא מורשה ואינו ייעוץ רפואי. אנו ממליצים לך לקבל החלטות בתחום הבריאות על סמך המחקר והשותפות שלך עם איש מקצוע מוסמך.
היקף המידע שלנו מוגבל לכירופרקטיקה, שרירים ושלד, תרופות פיזיות, בריאות, אטיולוגי תורם הפרעות ויסרוסומטיות במצגות קליניות, דינמיקה קלינית של רפלקס סומטויסצרלי, תסביכי תת-לוקסציה, בעיות בריאותיות רגישות ו/או מאמרים, נושאים ודיונים ברפואה תפקודית.
אנו מספקים ומציגים שיתוף פעולה קליני עם מומחים מדיסציפלינות שונות. כל מומחה נשלט על ידי היקף העיסוק המקצועי שלו וסמכות הרישיון שלו. אנו משתמשים בפרוטוקולים פונקציונליים של בריאות ובריאות כדי לטפל ולתמוך בטיפול בפציעות או הפרעות של מערכת השרירים והשלד.
הסרטונים, הפוסטים, הנושאים, הנושאים והתובנות שלנו מכסים עניינים קליניים, נושאים ונושאים הקשורים ותומכים במישרין או בעקיפין בהיקף העיסוק הקליני שלנו.*
משרדנו ניסה באופן סביר לספק ציטוטים תומכים וזיהה את המחקר או המחקרים הרלוונטיים התומכים בפוסטים שלנו. אנו מספקים עותקים של מחקרי מחקר תומכים הזמינים למועצות הרגולטוריות ולציבור על פי בקשה.
אנו מבינים כי אנו מכסים עניינים הדורשים הסבר נוסף כיצד זה עשוי לסייע בתכנית טיפול מסוימת או בפרוטוקול טיפולי; לכן, כדי לדון בהמשך בנושא לעיל, אנא אל תהסס לשאול ד"ר אלכס חימנז, די.סי, או צור איתנו קשר בכתובת 915-850-0900.
אנחנו כאן כדי לעזור לך ולמשפחתך.
ברכות
ד"ר אלכס חימנז זֶרֶם יָשָׁר, MSACP, RN*, CCST, IFMCP*, CIFM*, ATN*
דוא"ל: coach@elpasofunctionalmedicine.com
מורשה כדוקטור לכירופרקטיקה (DC) ב טקסס & ניו מקסיקו*
מס' רישיון טקסס DC TX5807, ניו מקסיקו DC # רישיון NM-DC2182
מורשה כאחות מוסמכת (RN*) in פלורידה
פלורידה רישיון RN רישיון # RN9617241 (מס' שליטה 3558029)
סטטוס קומפקטי: רישיון רב מדינות: מורשה להתאמן ב 40 מדינות*
ד"ר אלכס חימנז DC, MSACP, RN* CIFM*, IFMCP*, ATN*, CCST
כרטיס הביקור הדיגיטלי שלי






