אלסיו ננסיוני, איירין קאפה, סלווטורה קורטלינו
תקציר | הפגיעות של תאים סרטניים לחיסכון בחומרים מזינים והתלות שלהם במטבוליטים ספציפיים הם סימנים בולטים לסרטן. דיאטות בצום או בחיקוי (FMDs) מובילות לשינויים רחבים בגורמי גדילה וברמות מטבוליטים, המייצרות סביבות שיכולות להפחית את יכולתם של תאים סרטניים להסתגל ולשרוד ובכך לשפר את ההשפעות של טיפולים בסרטן. בנוסף, צום או FMDs מגבירים את ההתנגדות לכימותרפיה בתאים נורמליים אך לא סרטניים, ומקדמים התחדשות ברקמות רגילות, דבר שיכול לסייע במניעת תופעות לוואי מזיקות וסכנת חיים של טיפולים. בעוד הצום הוא כמעט נסבל על ידי חולים, מחקרים בבעלי חיים וקליניקים כאחד מראים כי מחזורי FMDs דל קלוריות הם ריאלי ובטוחה הכוללת. קיימים מספר ניסויים קליניים המעריכים את השפעת הצום או ה- FMD על תופעות לוואי של טיפול ועל תוצאות יעילות. אנו מציעים כי שילוב של FMDs עם כימותרפיה, אימונותרפיה או טיפולים אחרים מייצג אסטרטגיה פוטנציאלית מבטיח להגביר את יעילות הטיפול, למנוע רכישת התנגדות ולהפחית תופעות לוואי.
גורמים תזונתיים וסגנון חיים הם גורמים מרכזיים בסיכון לפתח סרטן, כאשר סוגי סרטן מסוימים תלויים יותר בהרגלי תזונה מאחרים1�
למרות בעשור האחרון אנו עדים לשינויים חסרי תקדים והתקדמות מרשימה בטיפול בסרטן XNXX, עדיין נותר צורך חיוני יותר יעיל, ואולי,
צום כוחות תאים בריאים להיכנס חלוקה איטית במצב מוגן מאוד המגינה עליהם מפני עלבונות רעילים הנגזרות תרופות אנטי סרטני תוך רגישות סוגים שונים של תאים סרטניים אלה therapeuticsXNXX. תגלית זו מרמזת כי התערבות תזונתיים אחת יכולה לסייע בטיפול בהיבטים שונים וחשובים לא פחות של טיפול בסרטן.
במאמר זה, אנו דנים ברציונל הביולוגי לשימוש בצום או בחיקוי של דיאטות (FMDs) כדי להבהיר TEAEs אלא גם כדי למנוע ולטפל בסרטן. כמו כן, אנו ממחישים את האזהרות של הניסוי האקספרימנטלי XNX ואת המחקרים הקליניים שפורסמו ומתמשכים בהם צוינו או צרו קשר עם חולי סרטן.
תוכן
תגובה צום מערכתית ותאית
צום מוביל לשינויים בפעילות של מסלולים מטבוליים רבים הקשורים עם המעבר למצב מסוגל לייצר אנרגיה מטבוליטים באמצעות מקורות פחמן שפורסמו בעיקר רקמת השומן ובחלקו מן השריר. השינויים ברמות ההורמונים והמטבוליטים המסתובבים מתורגמים לירידה בחלוקה לתאים פעילות מטבולית של תאים נורמליים, ובסופו של דבר להגן עליהם מפני chemotherapeutic התעללות XNXX. תאי סרטן, על ידי אי ציות לפקודות האנטי-צמיחה המוכתבות על-ידי תנאי הרעב האלה, יכולים לקבל תגובה הפוכה של תאים נורמליים ולכן הם הופכים לרגישות לכימותרפיה ולטיפולים אחרים.
תגובה מערכתית כדי צום
התגובה לצום מתוזמנת בחלקו על ידי רמות המחזור של גלוקוז, אינסולין, גלוקגון, הורמון גדילה (GH), IGF1, glucocorticoids
גלוקגון ורמות נמוכות של אינסולין מגרים גם את פירוק הטריגליצרידים (המאוחסנים בעיקר ברקמת השומן) לגליצרול וחומצות שומן חופשיות. במהלך הצום, רוב הרקמות משתמשות בחומצות שומן לצורך אנרגיה, בעוד שהמוח מסתמך על גלוקוז ועל גופי קטון המיוצרים על ידי הפטוציטים (ניתן לייצר גופי קטון מאצטיל-CoA הנוצר מחמצון חומצת שומן? או מחומצות אמיניות קטוגניות). בשלב הקטוגני של צום, גופי הקטון מגיעים לריכוזים בטווח המילימולרי, בדרך כלל מתחילים לאחר 2-3 ימים מתחילת הצום. יחד עם גליצרול וחומצות אמינו שמקורן בשומן, גופי קטון מתדלקים את הגלוקונאוגנזה, השומר על רמות הגלוקוז בריכוז של כ -4 מ"מ (70 מ"ג לד"ל), אשר משמש בעיקר על ידי המוח.
Glucocorticoids ואדרנלין גם לתרום לכוון את ההתאמות המטבוליות
לבסוף, צום מוריד את רמות הלפטין המסתובבים, הורמון המבוצע בעיקר על ידי אדיפוציטים המעכבים את הרעב, תוך הגברת רמות האדיפונקטין, מה שמגדיל את התפלגות חומצת השומן 23,24. לסיכום, סימני ההיכר של התגובה המערכית של היונקים לצום הם רמות נמוכות של גלוקוז ואינסולין, רמות גבוהות של גלוקגון וקטונים, רמות נמוכות של IGF1 ולפטין ורמות גבוהות של אדיפונקטין.
תגובה סלולרית לצום
התגובה של תאים בריאים לצום נשמרת מבחינה אבולוציונית ומעניקה הגנה לתאים, ולפחות באורגניזמים מודלים, הוכח כמגדיל את תוחלת החיים ואת תוחלת הבריאות12,22,25�31. ה-IGF1
צום והגבלת הגלוקוז הנובעת מעכבים את פעילות ה- PKA, מגבירים את פעילות ה- AMPK ומפעילים את ה- EGR1 ובכך משיגים השפעות מגנות על התאים, כולל אלה בשריר הלב 22,25,26. לבסוף, לצום ול- FMD (ראה להלן את הרכבם) יש גם את היכולת לקדם השפעות התחדשות (תיבה 1) על ידי מנגנונים מולקולריים, שחלקם היו מעורבים בסרטן, כגון אוטופגיה מוגברת או אינדוקציה של פעילות סירטואין 22,37 49 .

גישות דיאטה של סרטן FMDs
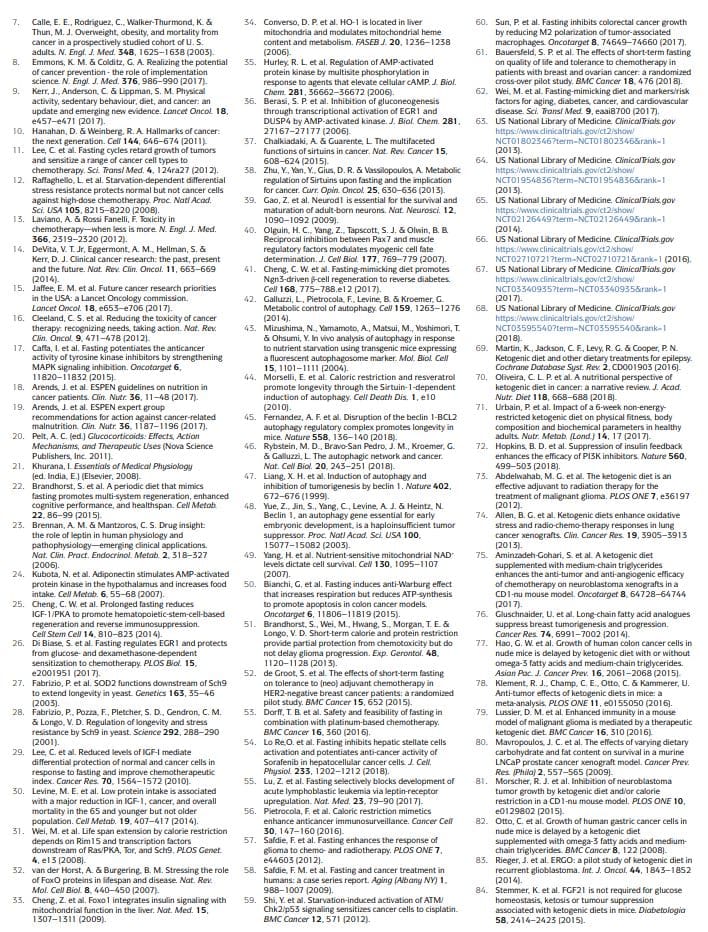
הגישות התזונתיות המבוססות על צום שנחקרו באופן נרחב יותר באונקולוגיה, הן פרה-קלינית והן קלינית, כוללות צום מים (הימנעות מכל המזון והמשקאות מלבד מים) ו-FMDs11,12,17,25,26,50�60 (טבלה 1). נתונים קליניים ראשוניים מצביעים על כך שייתכן שיידרש צום של לפחות 48 שעות כדי להשיג השפעות משמעותיות מבחינה קלינית באונקולוגיה, כגון מניעת נזק ל-DNA הנגרמת על ידי כימותרפיה לרקמות בריאות וסיוע בשמירה על
עם זאת, מרבית המטופלים מסרבים או מתקשים להשלים את צום המים, ואת הסיכונים הפוטנציאליים למחסור המורחב בקלוריות ובמיקרו-תזונה הקשורים אליו קשה להצדיק. מחלות קשב וריכוז הינן משטרים תזונתיים שתוכננו באופן רפואי דלים מאוד בקלוריות (כלומר, בדרך כלל בין 300 ל -1,100 קק"ל ליום), סוכרים וחלבונים המשחזרים רבות מההשפעות של צום מים בלבד אך עם תאימות טובה יותר של המטופל והפחתת הסיכון התזונתי 22,61,62, 3. במהלך לולאת קיבה, חולים מקבלים בדרך כלל כמויות בלתי מוגבלות של מים, מנות קטנות וסטנדרטיות של מרקי ירקות, מרקים, מיצים, חטיפי אגוזים ותה צמחים, כמו גם תוספי מזון תזונתיים. במחקר קליני שנערך על שלושה מחזורים חודשיים של מחלת מימפה בת 5 ימים בנבדקים בריאים בדרך כלל, הדיאטה נסבלת היטב והפחיתה את תא המטען ואת שומן הגוף הכולל, לחץ דם ורמות IGF1 בניסויים קליניים אונקולוגיים קודמים ומתמשכים, בדרך כלל ניתנו צום או FMD כל 62 - 3 שבועות, למשל, בשילוב עם משטרי כימותרפיה, ומשך הזמן שלהם נע בין 4 ל 1 ימים 5 52,53,58,61,63 . חשוב לציין כי לא דווח על תופעות לוואי חמורות (רמה G68 ומעלה, על פי קריטריוני המינוח הנפוצים לאירועים שליליים) במחקרים אלה 3.
דיאטות קטוגנית
דיאטות קטוגניות (KD) הן משטרים תזונתיים בעלי תכולת קלוריות, שומן עשיר ופחמימות נמוכה 69,70. ב- KD קלאסי, היחס בין משקל השומן למשקל המשולב של פחמימות וחלבון הוא 4: 1. ראוי לציין כי מחלות קשב וריאות הן קטוגניות מכיוון שיש בהן תכולת שומן גבוהה ויש להן יכולת לגרום לעלייה משמעותית (0.5 מ"מ לליטר) ברמות גופי הקטון המסתובבים. בבני אדם, KD יכול גם להפחית את רמות ה- IGF1 והאינסולין (ביותר מ -20% מערכי הבסיס), אם כי השפעות אלו מושפעות מרמות וסוגי הפחמימות והחלבונים בתזונה. KDs יכולים להפחית את רמות הגלוקוז בדם, אך בדרך כלל הם נשארים בטווח הנורמלי (כלומר,> 71mmol לליטר) 4.4.
יש לציין כי KDs עשויים להיות יעילים למניעת העלייה בגלוקוז ובאינסולין המתרחשת בדרך כלל בתגובה למעכבי PI3K, שהוצעה להגביל את יעילותם72. באופן מסורתי, KDs שימשו לטיפול באפילפסיה עמידה, בעיקר בילדים69. במודלים של עכברים, KDs מעוררים השפעות אנטי סרטניות, במיוחד בגליובלסטומה70,72�86. מחקרים קליניים מצביעים על כך שככל הנראה ל-KDs אין פעילות טיפולית מהותית כאשר משתמשים בהם כסוכנים בודדים בחולים עם סרטן ומציעים כי יש לחפש את היתרונות הפוטנציאליים של דיאטות אלו בשילוב עם גישות אחרות, כגון כימותרפיה, הקרנות, טיפולים אנטי-אנגיוגניים, מעכבי PI3K.
דיווחו כי ל- KD יש השפעות נוירו-מגן בעצבים פריפריאליים ובהיפוקמפוס 87,88. עם זאת, נותר לקבוע האם לחולי KD יש גם השפעות פרורגנרטיביות הדומות לצום או ל- FMD (תיבה 1) והאם ניתן להשתמש ב- KDs גם כדי להגן על יונקים חיים מפני רעילות כימותרפיה. יש לציין כי נראה שההשפעות ההתחדשותיות של צום או שלפיות מוחיות מוגדלות באמצעות המעבר ממצב תגובת הרעב, שכולל פירוק רכיבים תאיים ומוות של תאים רבים, ותקופת האכלה מחדש, בה עוברים תאים ורקמות. 22. שחזור מכיוון שקשרי KD אינם מכריחים כניסה למצב רעב, אינם מקדמים פירוק מרכיבי ורקמות תוך תאיות ואינם כוללים תקופת הזנה מחודשת, הם צפויים לגרום לסוג ההתחדשות המתואמת שנצפתה במהלך הזנה חוזרת.
הגבלת קלוריות
בעוד שהגבלת קלוריות כרונית (CR) ודיאטות חסרות חומצות אמינו ספציפיות שונות מאוד מצום תקופתי, הן חולקות עם צום ו- FMD הגבלה סלקטיבית פחות או יותר בחומרי תזונה, ויש להן השפעות אנטי סרטניות 81,89 112. CR כרוך בדרך כלל בהפחתה כרונית של 20% בצריכת האנרגיה מצריכת הקלוריות הרגילה שתאפשר לאדם לשמור על משקל תקין 30. זה יעיל מאוד בהפחתת גורמי סיכון קרדיווסקולריים ושכיחות סרטן באורגניזמים מודליים, כולל פרימטים 113,114.
עם זאת, CR יכול לגרום לתופעות לוואי, כגון שינויים במראה הגופני, רגישות מוגברת לקור, ירידה בכוח, אי סדרים במחזור החודשי, פוריות, אובדן ליבידו, אוסטאופורוזיס, ריפוי איטי יותר של פצעים, אובססיביות למזון, עצבנות ודיכאון. בחולים עם סרטן, יש חשש משמעותי כי הוא עלול להחמיר את תת התזונה וכי הוא יגרום באופן בלתי נמנע לאובדן יתר של מסת הגוף הרזה 18,113. CR מפחית את רמות הגלוקוז בדם בצום, אם כי הם נשארים בטווח הנורמלי 116. בבני אדם, CR כרוני אינו משפיע על רמות IGF114 אלא אם כן מיושמת גם הגבלת חלבונים מתונה 1.
מחקרים מראים כי על ידי הפחתת איתות mTORC1 בתאי פאנת, CR מגביר את תפקוד תאי הגזע שלהם, וכי הוא גם מגן על תאי גזע של תאי מעיים מ - DNAXXNXX, אך לא ידוע אם השפעות פרו - רגנרטיביות באיברים אחרים מועברות גם על ידי CR. לפיכך, הנתונים הזמינים מציעים כי צום FMDs ליצור פרופיל מטבולית, regenerative ומגונן כי הוא מובחן וכנראה חזק יותר מאשר זה עורר על ידי KD או CR.
צום ו FMD בטיפול: השפעות על רמות ההורמונים והמטבוליטים
רבים מהשינויים ברמות ההורמונים והמטבוליטים המופיעים בדרך כלל בתגובה לצום יש את היכולת להפעיל השפעות אנטי-חומריות (כלומר רמות נמוכות יותר של גלוקוז, IGF1, אינסולין ולפטין ורמות גבוהות של אדיפונקטין) 23,120,121 ו / או כדי להרשות לעצמם הגנה על רקמות בריאות מתופעות לוואי (כלומר, רמות מופחתות של IGF1 ו גלוקוז). בגלל גופים קטון יכול לעכב diacetylases היסטון (HDACs), העלייה בצום המושרה של גופי ketone עשוי לעזור להאט את הגידול הגידול ולקדם בידול באמצעות מנגנונים epigeneticXNXX.
עם זאת, הוכח שגוף הקטון אצטואצטט מאיץ, במקום להפחית, את הצמיחה של גידולים מסוימים, כגון מלנומות עם BRAF123 מוטציה. אותם שינויים שקיימים הראיות החזקות ביותר לתפקיד בהשפעות המועילות של צום וקשיי קיבה כנגד סרטן הם ההפחתה ברמות IGF1 והגלוקוז. ברמה המולקולרית, צום או FMD מפחית מפל איתות תאיים כולל IGF1R AKT mTOR S6K ו- cAMP PKA איתות, מגביר אוטופגיה, עוזר לתאים נורמליים לעמוד בלחץ ומעודד חסינות נגד סרטן 25,29,56,124
הפרעת לחץ דיפרנציאלי: הגדלת כימותרפיה סובלנות
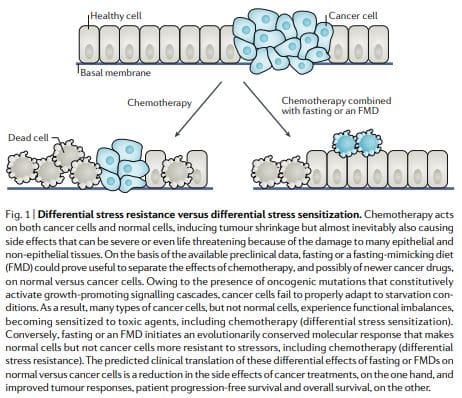
חלק אורתולוגים אונקוגן שמרים, כגון ראס ו Sch9 (אורתולוגיה תפקודית של S6K יונקים), מסוגלים להפחית את עמידות הלחץ במודל אורגניזמים 27,28. בנוסף, מוטציות המפעילות את IGF1R, RAS, PI3KCA או AKT, או כי לנטרל PTEN, נמצאים ברוב מקרי סרטן האדם XNXX. יחד, זה הוביל ההשערה כי רעב יגרום תופעות הפוכות בסרטן לעומת תאים נורמליים מבחינת היכולת שלהם לעמוד בלחץ התא, כולל כימותרפיה. במילים אחרות, רעב יכול להוביל
על פי השערת ה- DSR, תאים נורמליים מגיבים לרעב על ידי הפחתת גנים של ביוגנזה הקשורה לריבוזום ו / או הרכבה, מה שמאלץ את התאים להיכנס למצב של תחזוקה עצמית ומגן עליהם מפני הנזק שנגרם על ידי כימותרפיה, רדיותרפיה וגורמים רעילים אחרים. לעומת זאת, בתאים סרטניים, מצב של תחזוקה עצמית זו מונע באמצעות שינויים אונקוגניים, הגורמים לעיכוב מכונן במסלולי תגובת הלחץ 12 (איור 1). תואם את מודל ה- DSR, רעב לטווח קצר או מחיקת פרוטו-אונקוגן
תוצאות דומות הושגו בתאי יונקים: חשיפה לתאי גלוקוז נמוכה מוגנת בתאי גליה עכברתיים ראשוניים נגד רעילות מימן על-חמצני או cyclophosphamide (כימותרפיה פרו-חמצנית), אך לא הגנו על עכברים, עכברים וגליומה אנושית וקווי תאי סרטן נוירובלסטומה. בהתאם לתצפיות אלה,
מחקרים שנערכו לאחר מכן מצאו כי איתות IGF1 מופחת בתגובה לצום מגן על גליה ונוירונים ראשוניים, אך לא על תאי גליומה ונוירובלסטומה, מפני ציקלופוספמיד ומתרכובות פרו-חמצוניות ומגן על פיברובלסטים עובריים של העכבר מפני דוקסורוביצין 29. עכברים חסרי כבד ב- IGF1 (LID), בעלי חיים מהונדסים עם מחיקת גן Igf1 בכבד המותנים המציגים ירידה של 70% ברמות IGF80 במחזור (רמות דומות לאלה שהושגו בצום של 1 שעות בעכברים) 72, הוגנו מפני שלוש מתוך ארבע תרופות כימותרפיות שנבדקו, כולל דוקסורוביצין.
מחקרי היסטולוגיה הראו סימנים למיופתיה לבבית המושרה על ידי דוקסורוביצין רק בעכברי בקרה שטופלו בדוקסורוביצין אך לא בעכברי LID. בניסויים עם בעלי חיים הנושאים מלנומה שטופלו בדוקסורוביצין לא נצפה הבדל מבחינת התקדמות המחלה בין בקרת ועכברי LID, דבר המצביע על כך שתאים סרטניים לא היו מוגנים מפני כימותרפיה על ידי רמות IGF1 מופחתות. עם זאת, שוב, עכברי מכסה נושאי גידול גילו יתרון הישרדותי יוצא דופן בהשוואה לבעלי הביקורת בשל יכולתם לעמוד לרעילות דוקסורוביצין 29. לפיכך, בסך הכל, תוצאות אלו אישרו כי ויסות למטה של IGF1 הוא מנגנון מרכזי שבאמצעותו הצום מגביר את הסבילות לכימותרפיה.
שני מעכבי dexamethasone ו- mTOR נמצאים בשימוש נרחב בטיפול בסרטן, בין אם בשל יעילותם כאנטי-אמטיקה
התערבויות אלה מפחיתות את פעילות ה- PKA תוך הגברת פעילות ה- AMPK ובכך מפעילות את ה- EGR1, דבר המצביע על כך שאותות ה- PKA של cAMP מתווכים את ה- DSR המושרה בצום באמצעות EGR1 (נ"צ 26). EGR1 מקדם גם את הביטוי של פפטידים קרדיופקטורטיביים, כגון פפטיד natriuretic פרוזדורים (ANP) ופפטיד natriuretic מסוג B (BNP) ברקמת הלב, התורם לעמידות לדוקסורוביצין. יתר על כן, צום ו / או FMD עשויים להגן על עכברים מפני קרדיומיופתיה המושרה על ידי דוקסורוביצין על ידי הגברת האוטופאגיה, אשר עשויה לקדם את בריאות התאים על ידי הפחתת ייצור מינים של חמצן תגובתי (ROS) באמצעות ביטול המיטוכונדריה הלא מתפקדת ועל ידי הסרת אגרגטים רעילים.
בנוסף להפחתת רעילות המושרה על ידי כימותרפיה בתאים ולהגדלת ההישרדות של עכברים שטופלו בכימותרפיה, מחזורי צום גורמים להתחדשות מוח העצם ומונעים דיכוי חיסוני הנגרם על ידי ציקלופוספמיד באופן הקשור ל- PKA וקשור ל- IGF1 25. לפיכך, תוצאות משכנעות פרה-קליניות מצביעות על הפוטנציאל של צום וטרשת נפוצה להגביר את הסבילות לכימותרפיה ולהימנע מתופעות לוואי משמעותיות. מאחר ונתונים קליניים ראשוניים תומכים בפוטנציאל זה, מחקרים פרה-קליניים אלה בונים רציונל חזק להערכת מחלת הוושט במחקרים קליניים אקראיים עם TEAE כנקודת סיום ראשונית.
דיפרנציאלי מתח רגישות: הגדלת מותו של תאים סרטניים
אם בשימוש לבד, רוב התערבויות תזונתיים, כולל צום FMDs, יש השפעות מוגבלות מפני התקדמות סרטן. על פי ההבחנה של רגישות הלחץ (DSS), השילוב של צום או FMD עם טיפול שני הוא הרבה יותר מבטיח XNXX. השערה זו מנבאת כי בעוד תאים סרטניים מסוגלים להסתגל לריכוז מוגבל של חמצן וריכוז חומרים תזונתיים, סוגים רבים של תאים סרטניים אינם מסוגלים לבצע שינויים שיאפשרו הישרדות בסביבה חסרת התזונתיים והרעילה הנוצרת על ידי שילוב של צום וכימותרפיה , לדוגמה. ניסויים מוקדמים בסרטן השד, מלנומה
אנו רואים תגובה לא הולמת של תאים סרטניים לתנאים המשתנים, כולל הפחתת רמות IGF1 ורמת גלוקוז הנגרמות על ידי צום או FMD כמנגנון מפתח העומד בבסיס

על ידי הפחתת זמינות הגלוקוז והגברת חומצות השומן? חמצון, צום או FMD יכולים גם לקדם מעבר מגליקוליזה אירובית (אפקט ורבורג) לזרחת חמצון מיטוכונדריאלית בתאים סרטניים, דבר הכרחי לקיום צמיחת תאים סרטניים בסביבה דלה ביותר בחומרים מזינים 50 (איור 2). מתג זה מוביל להגברת ייצור ה- ROS 11 כתוצאה מפעילות נשימה מיטוכונדריאלית מוגברת ועשוי להיות כרוך בהפחתה בפוטנציאל החמצון הסלולרי עקב ירידה בסינתזת הגלוטתיון מגליקוליזה ומסלול פוספט פנטוז 50. ההשפעה המשולבת של הגדלת ROS והגנה מופחתת נגד נוגדי חמצון מגבירה מתח חמצוני בתאים סרטניים ומגבירה את הפעילות של כימותרפיה. יש לציין כי מכיוון שפעילות גליקוליטית גבוהה המופגנת על ידי ייצור לקטט גבוהה מנבאת תוקפנות ונטייה גרורתית בכמה סוגים של סרטן 129, ההשפעות האנטי-ורבגיות של צום או שלפוחית-לקוי עשויות להיות יעילות במיוחד כנגד סרטן אגרסיבי וגרורתי.
מלבד שינוי בחילוף החומרים, צום או FMDs לעורר שינויים אחרים שיכולים לקדם DSS בתאי סרטן הלבלב. צום מגביר את רמות הביטוי של
לבסוף, צום יכול upregulate קולטן לפטין במורד הזרם שלה
יש לציין כי סביר להניח כי סוגים רבים של תאי סרטן, כולל AML29, יכולים לרכוש עמידות על ידי עקיפת השינויים המטבוליים המוטלים על ידי צום או קשיי קיבה, אפשרות שמגדילה עוד יותר על ידי ההטרוגניות המטבולית המאפיינת סרטן רבים 129. לפיכך, מטרה עיקרית לעתיד הקרוב תהיה זיהוי סוגי הסרטן הרגישים ביותר למשטרי תזונה אלה באמצעות סמנים ביולוגיים. מאידך, כאשר בשילוב עם טיפולים סטנדרטיים, צום או מחלת קשב וריאות גרמו לעיתים רחוקות לרכישת עמידות במודלים של עכברים סרטניים, והתנגדות לצום בשילוב עם כימותרפיה אינה שכיחה גם במחקרים במבחנה, והדגישה את החשיבות בזיהוי טיפולים ש, בשילוב עם מחלות קשב וריון, נגרמים השפעות רעילות חזקות על תאים סרטניים עם רעילות מינימאלית לתאים ולרקמות נורמליות 11,17,50,55 57,59,124.
שיפור חסינות על ידי צום או FMD
נתונים אחרונים מראים כי צום או FMDs בעצמם, ובמידה רבה יותר בשילוב עם כימותרפיה, לגרום להרחבת אבות הלימפה ולקדם
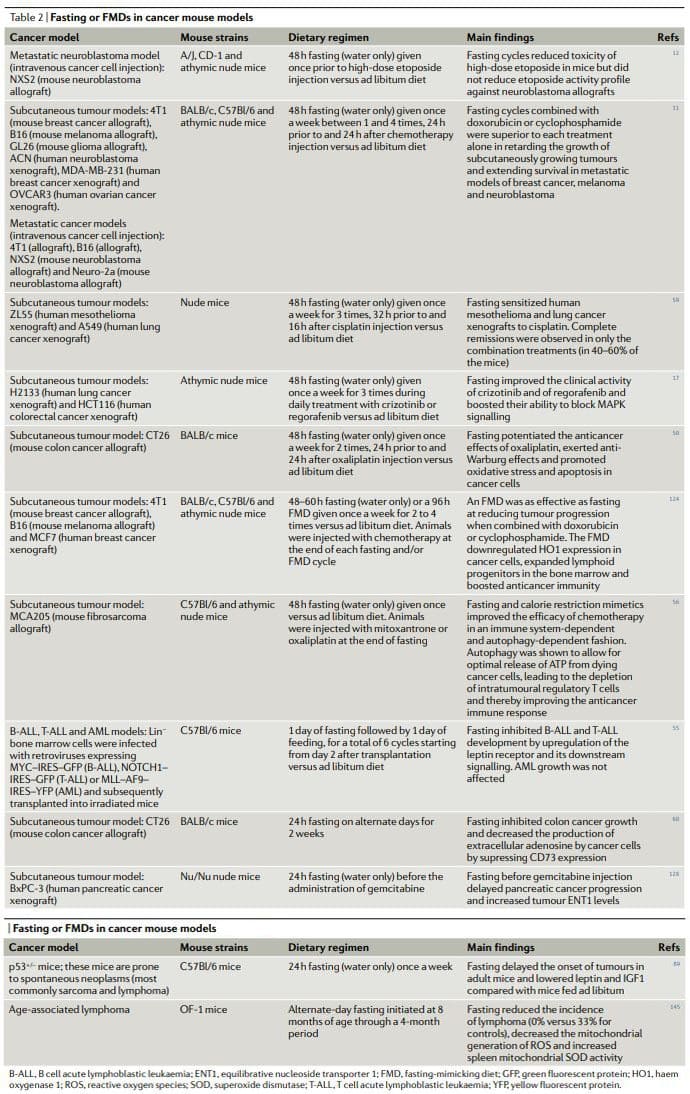
דיאטות נגד סרטן במודלים של עכבר
בסך הכל, התוצאות של מחקרים פרה-קליניים על צום או שלפוחית-בטן במודלים של סרטן בבעלי חיים, כולל מודלים לסרטן גרורתי (טבלה 2), מראות כי צום תקופתי או א.ס.וו משיגים תופעות אנטי-סרטניות פליי-טרופיות ומעצימים את הפעילות של כימותרפיות ו- TKI תוך הפעלת השפעות מגן ומתחדשות. באיברים מרובים 22,25. השגת אותן תופעות ללא צום ו / או מחלות קשב וריכוז תדרוש תחילה זיהוי ולאחר מכן שימוש במספר תרופות יעילות, יקרות ולעיתים קרובות רעילות וככל הנראה יהיה ללא היתרון של גרימת הגנה על תאים בריאים. ראוי לציין כי לפחות בשני מחקרים צום בשילוב עם כימותרפיה הוכיחו את עצמם כהתערבות היחידה המסוגלת להשיג רגרסיות מוחלטות של הגידול או הישרדות ארוכת טווח בשבר עקבי של בעלי החיים שטופלו.
KDS כרוני גם להראות
CR הפחית גידולים במודלים גנטיים של סרטן עכברים, מודלים של עכברים עם גידול ספונטני ומודלים של עכבר סרטן המושרה מסרטן, כמו גם בקופים 91,92,97,98,101,102,104�106,108,109,136�138. לעומת זאת, מחקר מצא ש-CR מגיל העמידה למעשה מגביר את השכיחות של ניאופלזמות של תאי פלזמה בעכברי C57Bl/6. עם זאת, באותו מחקר, CR גם האריך את תוחלת החיים המקסימלית בכ-139%, והעלייה שנצפתה בשכיחות הסרטן יוחסה לאריכות החיים המוגברת של עכברים שעברו CR, הגיל שבו
חשוב לציין, CR שיפרה את פעילות הטיפול בסרטן בכמה מודלים של סרטן, כולל פעילות של נוגדנים נגד IGF1R (ganitumab) נגד סרטן הערמונית XNXX, Cyclophosphamide נגד תאי נוירובלסטומה XNogX ו עיכוב autophagy ב xenografts של HRAS-G141Vtransformed התינוק התינוק בתאי אפיתל בת אלמוות XXX. עם זאת, CR או KD בשילוב עם טיפולים antancer נראה פחות יעיל מאשר בצום. מחקר עכבר מצא כי בניגוד לצום בלבד, CR לבדו לא היה מסוגל להפחית את הצמיחה של גלוקומה עכבר GL135 העכבר התת-עורית, וכי שוב, בניגוד לצום לטווח קצר, CR לא הגביר את הפעילות cisplatin נגד השד 12T100 תת עורית tumours26. באותו מחקר, הצום גם הוכיח באופן משמעותי יותר יעיל CR ו KD על הגדלת הסבילות של doxorubicin4. למרות הצום או FMD, CR ו- KD סביר לפעול על ו לחצות חפיפה
השלב של refeeding יכול אז
צום ו FMDs במניעת סרטן
מחקרים אפידמיולוגיים ומחקרים בבעלי חיים, כולל קופים 108,109,144, ובני אדם תומכים ברעיון כי CR כרוני וצום תקופתי ו / או FMD יכולים להיות בעלי השפעה מונעת סרטן אצל בני אדם. עם זאת, CR בקושי יכול להיות מיושם בכלל האוכלוסייה בשל בעיות של תאימות תופעות לוואי אפשריות 115. לכן, בעוד שהמלצות המבוססות על ראיות של מזון להעדיף (או להימנע מהן) וכן המלצות על סגנון חיים להקטנת הסיכון לסרטן, הופכות ל- NXX, המטרה כעת היא לזהות, ואולי אף לקבוע סטנדרט של משטרי תזונה תקופתיים, עם רמות נמוכות או ללא תופעות לוואי ולהעריך את היעילות המונעת סרטן במחקרים קליניים.
כפי שצוין קודם לכן, מחזורי FMD גורמים לדלגולציה של IGF1 ו גלוקוז ו upregulation של IGFBP1 ו גופי ketone, אשר שינויים דומים לאלה הנגרמים על ידי צום עצמו הם סמנים ביולוגיים של תגובה בצום XXX. כאשר C22Bl / 57 עכברים (אשר באופן ספונטני לפתח
מחקר קודם של צום חלופי, שבוצע בעכברים בגיל העמידה במשך סך של 4 חודשים, מצא גם כי צום מופחת את השכיחות של לימפומה, מביא אותו מ 33% (עבור עכברים שליטה) כדי 0% (בצום בעלי חיים) 145, אם כי בגלל משך הזמן הקצר של המחקר לא ידוע אם משטר צום זה מנע או פשוט עיכב את
לפיכך, התוצאות המבטיחות של מחקרים פרה קליניים בשילוב עם נתונים קליניים על ההשפעה של FMD על גורמי הסיכון עבור
תחולת קלינית באונקולוגיה
ארבעה מחקרי היתכנות של צום ו- FMDs בחולים שעברו טיפולי כימותרפיה פורסמו נכון להיום 52,53,58,61. בסדרת מקרים של חולי 10 שאובחנו עם סוגים שונים של סרטן, כולל השד, הערמונית, השחלות, הרחם, הריאות וסרטן הוושט, אשר צום מרצון עד 140hours לפני ו / או עד 56hours לאחר כימותרפיה, לא נגרמו תופעות לוואי עיקריות על ידי צום עצמו מלבד רעב סחרחורת דווחו NNX. חולים אלו (שש) שעברו כימותרפיה עם וללא צום דיווחו על ירידה משמעותית בעייפות, חולשה ואירועים שלילי במערכת העיכול בזמן הצום. בנוסף, בחולים בהם ניתן להעריך את התקדמות הסרטן, הצום לא מנע הפחתה בהורדת הכימותרפיה בהיקף הגידול או בסמני הגידול. במחקר אחר, נשים שטופלו ב- HER58, הידועות גם בשם ERBB13, שליליות, שלב II / III, שקיבלו כימותרפיה ניאו-אדג'ובנטית, אדרימיצין וטיפול ציקלופוספאמיד (TAC) חולקו באקראי למים (X בלבד) לפני ואחרי תחילת הכימותרפיה או לתזונה על פי הנחיות סטנדרטיות 2.
צום לטווח קצר נסבל היטב והפחית את הירידה בספירת אריתרוציטים וטרומבוציטים 7 ימים לאחר כימותרפיה. מעניין שבמחקר זה, רמות ה-? -H2AX (סמן של נזק ל- DNA) הועלו 30 דקות לאחר כימותרפיה בלוקוציטים מחולים שאינם בצום, אך לא בחולים שצמו. בהסלמת מינון של צום בחולים שעברו כימותרפיה על בסיס פלטינה, 20 חולים (שטופלו בעיקר בסרטן השתן, השחלה או בשד) חולקו באקראי לצום במשך 24, 48 או 72 שעות (מחולק כ- 48 שעות לפני כימותרפיה ו- 24 שעות לאחר כימותרפיה 53. קריטריוני היתכנות (שהוגדרו כשלושה או יותר מתוך שישה נבדקים בכל קבוצה הצורכים 200 קק"ל ליום בתקופה המהירה ללא רעילות עודפת) התקיימו. רעילות הקשורה לצום
לאחרונה, ניסוי אקראי של קרוסופר נערך על מנת להעריך את ההשפעות של FMD על איכות החיים ותופעות הלוואי של כימותרפיה בסך של 34 חולים עם סרטן השד או השחלות XNXX. ה- FMD כלל
אתגרים במרפאה
המחקר של צום תקופתי או של FMDs באונקולוגיה אינו נטול חששות, במיוחד ביחס לאפשרות שסוג זה של משטר תזונתי עלול להאיץ תת-תזונה, סרקופניה,
מסקנות
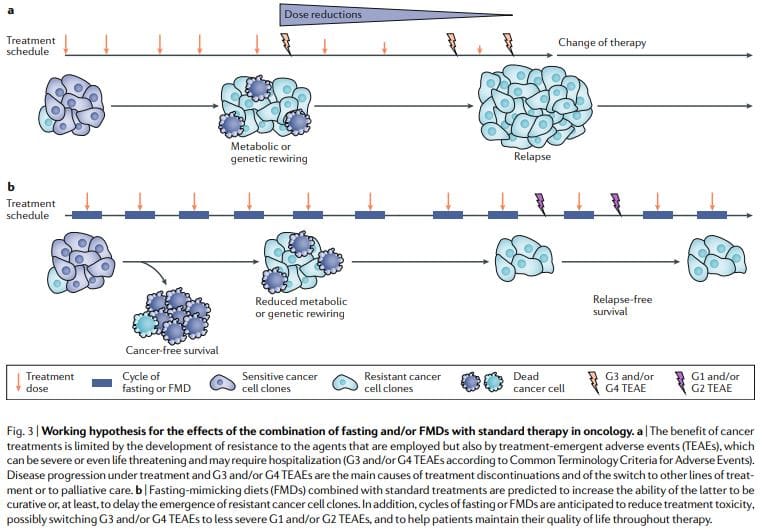
צום תקופתי או מחלות קשב וריכוז מראים באופן עקבי השפעות אנטי סרטניות חזקות במודלים של סרטן העכברים, כולל יכולת לחזק כימותרפיה ו TKI ולהפעיל חסינות נגד סרטן. מחזורי FMD אפשריים יותר ממשטרי תזונה כרוניים מכיוון שהם מאפשרים לחולים לצרוך מזון באופן קבוע במהלך ה- FMD, לשמור על תזונה רגילה בין מחזור למחזור ואינם גורמים לירידה חמורה במשקל ואולי להשפעות מזיקות על המערכת החיסונית והאנדוקרינית. יש לציין כי טיפולים עצמאיים, צום תקופתי או מחזורי FMD מראים ככל הנראה יעילות מוגבלת כנגד גידולים מבוססים. למעשה, בעכברים, צום או מחלת קשב וריכוז משפיעים על התקדמותם של מספר סוגי סרטן בדומה לכימותרפיה, אך לבדם, הם לעתים נדירות תואמים את ההשפעה המתקבלת בשילוב עם תרופות לסרטן העלולות לגרום להישרדות ללא סרטן. לפיכך, אנו מציעים כי השילוב של מחזורי FMD תקופתיים עם טיפולים סטנדרטיים הוא הטמון בפוטנציאל הגבוה ביותר לקידום הישרדות ללא סרטן בחולים, כפי שהוצע על ידי דגמי העכברים 11,59 (איור 11,59).
שילוב זה עשוי להיות חזק במיוחד מכמה סיבות: ראשית, תרופות לסרטן וטיפולים אחרים יכולים להיות יעילים, אך חלק מהחולים אינם מגיבים מכיוון שתאי הסרטן מאמצים אסטרטגיות מטבוליות חלופיות שמובילות להישרדות. מצבים מטבוליים חלופיים אלה הרבה יותר קשים לקיום בתנאי צום או FMD בגלל הליקויים או השינויים בגלוקוז, חומצות אמינו מסוימות, הורמונים וגורמי גדילה, כמו גם במסלולים לא ידועים אחרים המוליכים למוות של תאים. שנית, צום או FMDs יכול למנוע או להפחית את התנגדות ההתנגדות. שלישית, צום או FMDs להגן על תאים נורמליים ואיברים מתופעות הלוואי שנגרמות על ידי מגוון רחב של תרופות לסרטן. על בסיס עדויות פרה קליניות וקליניות לבטיחות, בטיחות ויעילות (בהפחתת IGF1, שומן בקר
יתר על כן, חיוני ליישם חולי FMD עם הבנה של מנגנוני הפעולה, מאז כוחם
מחקרים קליניים מתמשכים של FMD בחולים עם סרטן63,65�68 יספקו תשובות מוצקות יותר לגבי האם רישום של FMD תקופתיים בשילוב עם תרופות נוגדות סרטן קונבנציונליות עוזר לשפר את הסבילות והפעילות של האחרונים. חשוב לקחת בחשבון ש-FMD לא יהיו יעילים בהפחתת תופעות הלוואי של טיפולי סרטן בכל החולים וגם לא יפעלו לשיפור היעילות של כל הטיפולים, אבל יש להם פוטנציאל גדול לעשות זאת לפחות בחלק ואולי אף. עבור חלק גדול מהחולים והתרופות. אין לרשום חולים חלשים או מתת-תזונה או חולים בסיכון לתת-תזונה למחקרים קליניים של צום או FMD, ויש לעקוב בקפידה אחר מצב התזונה ואנורקסיה של החולה במהלך הניסויים הקליניים.
הפניות:
המידע כאן בנושא "צום וסרטן: מנגנונים מולקולריים ויישום קליני" אינו מיועד להחליף מערכת יחסים אחד על אחד עם איש מקצוע מוסמך בתחום הבריאות או רופא מורשה ואינו ייעוץ רפואי. אנו ממליצים לך לקבל החלטות בתחום הבריאות על סמך המחקר והשותפות שלך עם איש מקצוע מוסמך.
היקף המידע שלנו מוגבל לכירופרקטיקה, שרירים ושלד, תרופות פיזיות, בריאות, אטיולוגי תורם הפרעות ויסרוסומטיות במצגות קליניות, דינמיקה קלינית של רפלקס סומטויסצרלי, תסביכי תת-לוקסציה, בעיות בריאותיות רגישות ו/או מאמרים, נושאים ודיונים ברפואה תפקודית.
אנו מספקים ומציגים שיתוף פעולה קליני עם מומחים מדיסציפלינות שונות. כל מומחה נשלט על ידי היקף העיסוק המקצועי שלו וסמכות הרישיון שלו. אנו משתמשים בפרוטוקולים פונקציונליים של בריאות ובריאות כדי לטפל ולתמוך בטיפול בפציעות או הפרעות של מערכת השרירים והשלד.
הסרטונים, הפוסטים, הנושאים, הנושאים והתובנות שלנו מכסים עניינים קליניים, נושאים ונושאים הקשורים ותומכים במישרין או בעקיפין בהיקף העיסוק הקליני שלנו.*
משרדנו ניסה באופן סביר לספק ציטוטים תומכים וזיהה את המחקר או המחקרים הרלוונטיים התומכים בפוסטים שלנו. אנו מספקים עותקים של מחקרי מחקר תומכים הזמינים למועצות הרגולטוריות ולציבור על פי בקשה.
אנו מבינים כי אנו מכסים עניינים הדורשים הסבר נוסף כיצד זה עשוי לסייע בתכנית טיפול מסוימת או בפרוטוקול טיפולי; לכן, כדי לדון בהמשך בנושא לעיל, אנא אל תהסס לשאול ד"ר אלכס חימנז, די.סי, או צור איתנו קשר בכתובת 915-850-0900.
אנחנו כאן כדי לעזור לך ולמשפחתך.
ברכות
ד"ר אלכס חימנז זֶרֶם יָשָׁר, MSACP, RN*, CCST, IFMCP*, CIFM*, ATN*
דוא"ל: coach@elpasofunctionalmedicine.com
מורשה כדוקטור לכירופרקטיקה (DC) ב טקסס & ניו מקסיקו*
מס' רישיון טקסס DC TX5807, ניו מקסיקו DC # רישיון NM-DC2182
מורשה כאחות מוסמכת (RN*) in פלורידה
פלורידה רישיון RN רישיון # RN9617241 (מס' שליטה 3558029)
סטטוס קומפקטי: רישיון רב מדינות: מורשה להתאמן ב 40 מדינות*
ד"ר אלכס חימנז DC, MSACP, RN* CIFM*, IFMCP*, ATN*, CCST
כרטיס הביקור הדיגיטלי שלי