גופי קטון נוצרים על ידי הכבד ומשמשים כמקור אנרגיה כאשר גלוקוז אינו זמין בגוף האדם. שני גופי הקטון העיקריים הם אצטואצטט (AcAc) ו- 3-beta-hydroxybutyrate (3HB), ואילו אצטון הוא גוף הקטון השלישי והנפוץ ביותר. קטונים קיימים תמיד בדם ורמותיהם עולות במהלך צום ופעילות גופנית ממושכתKetogenesis הוא תהליך ביוכימי שבו אורגניזמים מייצרים גופי קטון דרך התמוטטות של חומצות שומן וחומצות אמינו קטוגניות.
גופי Ketone נוצרים בעיקר ב המיטוכונדריה של תאי הכבד. Ketogenesis מתרחשת כאשר יש רמות גלוקוז נמוכות בדם, במיוחד לאחר חנויות פחמימות סלולריות אחרות, כגון גליקוגן, כבר מותש. מנגנון זה יכול להתרחש גם כאשר יש כמות מספקת של אינסולין. הייצור של גופי ketone הוא יזמה בסופו של דבר כדי להפוך אנרגיה זמינה אשר מאוחסן בגוף האדם כמו חומצות שומן. Ketogenesis מתרחשת במיטוכונדריה שבה הוא מוסדר באופן עצמאי.
תוכן
תַקצִיר
קטון הגוף מטבוליזם הוא הצומת המרכזי בהומיאוסטזיס פיזיולוגי. בסקירה זו, אנו דנים כיצד קטונים משרתים תפקידים מטבוליים מובחנים של כוונון עדין, אשר מייעלים את הביצועים של איברים ואורגניזמים בשרידי מזון שונים ומגינים מפני דלקת ופציעה במערכות איברים מרובות. באופן מסורתי נתפס מצעים מטבוליים התגייס רק להגבלת הפחמימות, תצפיות האחרונות מדגישות את החשיבות של גופים קטון כמו מטבולי חיוני מתווכים איתות כאשר הפחמימות הן בשפע. משלימים רפרטואר של אפשרויות טיפוליות ידועים עבור מחלות של מערכת העצבים, תפקידים פוטנציאליים עבור גופי ketone בסרטן נוצרו, כמו גם תפקידים מגן מסקרן בלב וכבד, פתיחת אפשרויות טיפוליות הקשורות בהשמנת יתר ומחלות לב וכלי דם. מחלוקות של מטבוליזם קטון אותות נדונים כדי ליישב דוגמה קלאסית עם תצפיות עכשוויות.
מבוא
גופי קטון הם מקור דלק מטבולי אלטרנטיבי חיוני לכל תחומי החיים, האאוקריה, החיידקים והארכאים (Aneja et al., 2002; Cahill GF Jr, 2006; Krishnakumar et al., 2008). חילוף החומרים בגוף הקטון בבני אדם ממונף על מנת לתדלק את המוח בתקופות אפיזודיות של מחסור בחומרים מזינים. גופי קטון שזורים במסלולים מטבוליים מכריעים של יונקים כמו? -חמצון (FAO), מחזור החומצה הטריקרבוקסילית (TCA), גלוקונאוגנזה, ליפוגנזה דה נובו (DNL) וביוסינתזה של סטרולים. אצל יונקים, גופי קטון מיוצרים בעיקר בכבד מאצטיל-CoA שמקורם ב- FAO, והם מועברים לרקמות חוץ-כבדות לצורך חמצון סופני. פיזיולוגיה זו מספקת דלק חלופי המוגבר על ידי תקופות צום קצרות יחסית, מה שמגדיל את זמינות חומצות השומן ומפחית את זמינות הפחמימות (Cahill GF Jr, 2006; McGarry and Foster, 1980; Robinson and Williamson, 1980). חמצון גוף קטון הופך לתורם משמעותי לחילוף החומרים הכללי של יונקים בתוך רקמות חוץ-כבדות במספר עצום של מצבים פיזיולוגיים, כולל צום, רעב, תקופת הילודים, לאחר האימון, הריון, והקפדה על דיאטות דלות בפחמימות. מחזור הריכוז הכולל של קטון בגוף בבני אדם מבוגרים בריאים מציג בדרך כלל תנודות ביממה בין 100-250 מ"מ, עולה ל ~ 1 מ"מ לאחר פעילות גופנית ממושכת או 24 שעות בצום, ויכול להצטבר עד 20 מ"מ במצבים פתולוגיים כמו קטואצידוזיס סוכרתית ( Cahill GF Jr, 2006; Johnson et al., 1969b; Koeslag et al., 1980; Robinson and Williamson, 1980; Wildenhoff et al., 1974). הכבד האנושי מייצר עד 300 גרם של גופי קטון ביום (Balasse and Fery, 1989), שתורמים בין 5% מכלל ההוצאה האנרגטית במדינות מוזנות, בצום ומורעב (Balasse et al., 20; Cox et. al., 1978).
מחקרים אחרונים מדגישים כעת תפקידים הכרחיים עבור גופי קטון בחילוף החומרים בתאי יונקים, הומיאוסטזיס, ומסמנים תחת מגוון רחב של מצבים פיזיולוגיים ופתולוגיים. מלבד השימוש בדלקי אנרגיה לרקמות חוץ-כמויות, כגון שרירי מוח, לב או שרירי השלד, גופי קטון ממלאים תפקידים מרכזיים כמגשרים איתותים, נהגים של שינוי חלבונים לאחר טרנסלוציאציה (PTM), ומודולים של דלקת או מתח חמצוני. בסקירה זו, אנו מספקים הן קלאסית ומודרנית תצוגות של תפקידים pleiotropic של גופי קטון ואת חילוף החומרים שלהם.
סקירה כללית של מטבוליזם הגוף קטון
קצב הקטוגנזה בכבד נשלט על ידי סדרה מתוזמרת של שינויים פיזיולוגיים וביוכימיים של שומן. הרגולטורים העיקריים כוללים ליפוליזה של חומצות שומן מטריאצילגליצרולים, הובלה אל עבר קרום הפלזמה של הפטוציטים, הובלה למיטוכונדריה דרך קרניטין פלמיטוילטרנספרז 1 (CPT1), ספירלת חמצון?, פעילות מחזור TCA וריכוזים בינוניים, פוטנציאל חידוש, והווסתים ההורמונליים. מתהליכים אלה, בעיקר גלוקגון ואינסולין [נבדקו ב- (Arias et al., 1995; Ayte et al., 1993; Ehara et al., 2015; Ferre et al., 1983; Kahn et al., 2005; McGarry and Foster) , 1980; וויליאמסון ואח ', 1969)]. קטוגנזה קלאסית נתפסת כנתיב זליגה, שבו אצטיל-CoA הנגזר מ- חמצון עולה על פעילות הסינתזה של ציטראט ו / או זמינות של אוקסאלו-אצטט להתעבות ליצירת ציטראט. תוצרי ביניים של שלושה פחמנים מציגים פעילות אנטי-קטוגנית, ככל הנראה בשל יכולתם להרחיב את מאגר האוקסלו-אצטט לצריכת אצטיל-CoA, אך ריכוז אצטיל-CoA בכבד בלבד אינו קובע את קצב הקטוגני (פוסטר, 1967; Rawat ו- Menahan, 1975; Williamson ואח ', 1969). ויסות הקטוגנזה על ידי אירועים הורמונליים, תעתיקיים ואחרי תרגום תומכים יחד ברעיון שהמנגנונים המולקולריים שמכוונים קצב קטוגני עדין נותרים מובנים לחלוטין (ראה תקנה של HMGCS2 ו- SCOT / OXCT1).
קטוגנזה מתרחשת בעיקר במטריצה המיטוכונדריה בכבד בשיעורים פרופורציונליים לחמצון השומן הכולל. לאחר הובלה של שרשראות אצטיל על פני הממברנות המיטוכונדריה ו-חמצון, האיזופורם המיטוכונדריאלי של סינתזה 3-הידרוקסימאתיל גלוטריאל-קו-א (HMGCS2) מזרז את הגורל לביצוע עיבוי של אצטו-אצטיל-קו-א (AcAc-CoA) ואצטיל-קו א ליצירת HMG-CoA (איור 1 א). HMG-CoA lyase (HMGCL) חותך את HMG-CoA לשחרור אצטיל-CoA ו- acetoacetate (AcAc), והאחרון מצטמצם ל- d -? - hydroxybutyrate (d-? OHB) על ידי פוספטידילכולין תלוי פוספטידילכולין d-? OHB dehydrogenase ( BDH1) בתגובה קרובה לשיווי משקל בשילוב NAD + / NADH (Bock and Fleischer, 1975; LEHNINGER et al., 1960). קבוע שיווי המשקל BDH1 מעדיף ייצור d-? OHB, אך היחס בין גופי קטון AcAc / d-? OHB פרופורציונלי ישיר ליחס NAD + / NADH המיטוכונדריאלי, וכך פעילות BDH1 oxidoreductase ממודדת את פוטנציאל החמצון המיטוכונדריאלי (Krebs et al., 1969; ויליאמסון ואח ', 1967). AcAc יכול גם לדקרבוקסילט באופן ספונטני לאצטון (Pedersen, 1929), מקור הריח המתוק בבני אדם הסובלים מקטואצידוזיס (כלומר, סך כל גופי הקטונים בסרום> ~ 7 מ"מ; AcAc pKa 3.6,? OHB pKa 4.7). המנגנונים שבאמצעותם מועברים גופי קטון על פני הממברנה הפנימית המיטוכונדריאלית אינם ידועים, אך AcAc / d-? OHB משתחררים מתאים באמצעות מעבירים מונו-קרבוקסילטים (אצל יונקים, MCT 1 ו- 2, הידועים גם כמובילים מומסים 16A בני משפחה 1 ו 7) ומועבר במחזור לרקמות חוץ-כבדות לחמצון סופני (Cotter et al., 2011; Halestrap and Wilson, 2012; Halestrap, 2012; Hugo et al., 2012). ריכוזי גופי הקטון במחזור גבוהים יותר מאלו ברקמות החוץ-כבדות (הריסון ולונג, 1940) המצביעים על גופי קטון מועברים במדרון ריכוז. מוטציות של אובדן תפקוד ב- MCT1 קשורות להתקפים ספונטניים של קטואצידוזיס, דבר המצביע על תפקיד קריטי בייבוא גוף הקטון.
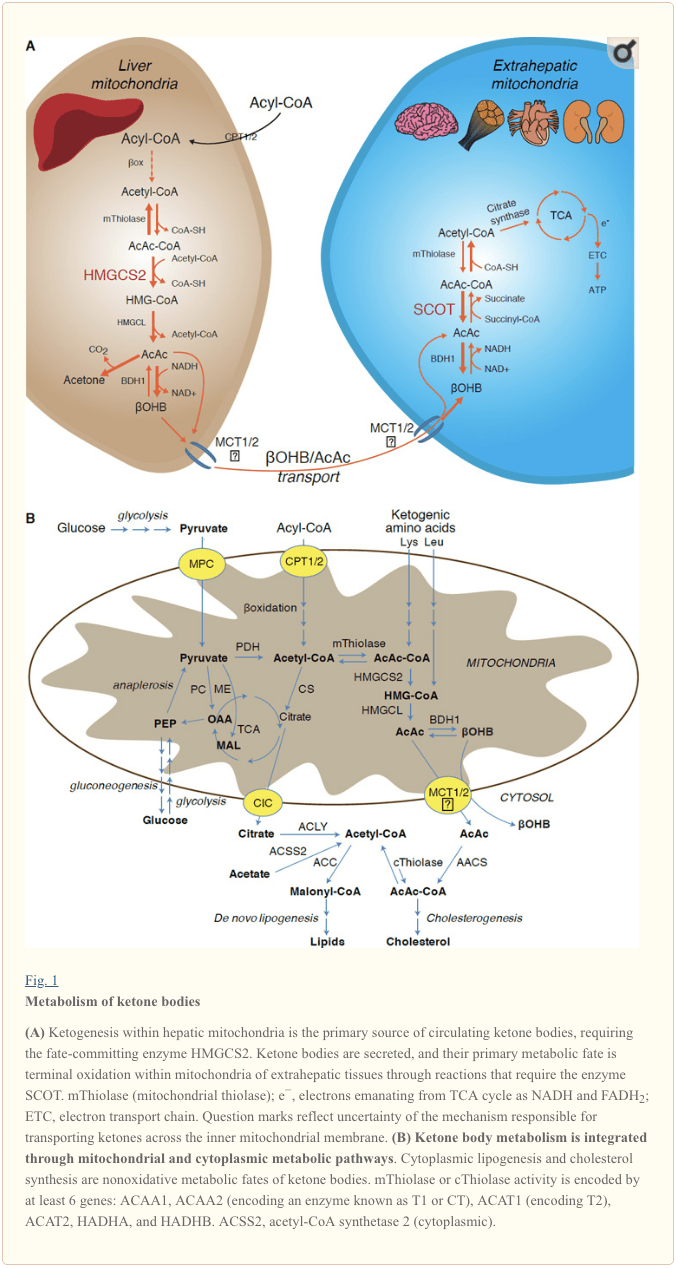
למעט פיזור פוטנציאלי של גופי קטון לגורלות שאינן מחמצנות (ראה גורלות מטבוליים שאינם מחמצנים של גופי קטון), לפטוציטים אין יכולת לחילוף חומרי גופי הקטון שהם מייצרים. גופי קטון המסונתזים דה נובו על ידי כבד הם (i) מצטברים במיטוכונדריה של רקמות חוץ-כבדות לאצטיל-CoA, הזמינים למחזור TCA לחמצון סופני (איור 1 א), (ii) מופנים למסלולי הליפוגנזה או סינתזת הסטרול ( איור 1B), או (iii) מופרש בשתן. כדלק אנרגטי חלופי, גופי הקטון מתחמצנים בלב, בשרירי השלד ובמוח (Balasse and Fery, 1989; Bentourkia et al., 2009; Owen et al., 1967; Reichard et al., 1974; Sultan, 1988 ). BDH1 מיטוכונדריאלי חוץ-כבד מזרז את התגובה הראשונה של חמצון? OHB, וממיר אותו לגב AcAc (LEHNINGER et al., 1960; Sandermann et al., 1986). ל- d-? OHB-dehydrogenase (BDH2) ציטופלזמי עם זהות רצף של 20% בלבד ל- BDH1 יש Km גבוה לגופי קטון, והוא גם ממלא תפקיד בהומאוסטזיס ברזל (Davuluri et al., 2016; Guo et al., 2006). . במטריקס מיטוכונדריאלי חוץ-כבד, AcAc מופעל ל- AcAc-CoA באמצעות חילוף של CoA- מחלקה מ- succinyl-CoA בתגובה מזרזת על ידי טרנספרז CoA יונקי ייחודי, succinyl-CoA: טרנספרז 3-oxoacid-CoA (SCOT, CoA transferase; מקודד על ידי OXCT1), דרך תגובת שיווי משקל כמעט. האנרגיה החופשית המשתחררת על ידי הידרוליזה של AcAc-CoA גדולה מזו של succinyl-CoA, ומעדיפה היווצרות AcAc. לפיכך שטף חמצון בגוף הקטון מתרחש עקב פעולה המונית: אספקה בשפע של AcAc וצריכה מהירה של אצטיל-CoA באמצעות סינתז ציטראט מעדיפה היווצרות AcAc-CoA (+ succinate) על ידי SCOT. יש לציין שבניגוד לגלוקוז (hexokinase) וחומצות שומן (acyl-CoA synthetases), הפעלת גופי קטון (SCOT) לצורה מחמצנת אינה דורשת השקעה של ATP. תגובה הפיכה של AcAc-CoA תיאולאז [מזרזת על ידי אחד מארבעת התיולזות המיטוכונדריאליות המקודדות על ידי ACAA2 (המקודד לאנזים המכונה T1 או CT), ACAT1 (המקודד T2), HADHA או HADHB] מניבה שתי מולקולות של אצטיל-CoA, שנכנסים למחזור ה- TCA (הרש וג'נקקס, 1967; שטרן ואח ', 1956; וויליאמסון ואח', 1971). במצבים קטוטיים (כלומר, סך כל הקטונים בסרום> 500M) גופי הקטון הופכים לתורמים משמעותיים להוצאות האנרגיה ומנוצלים ברקמות במהירות עד שמתרחשת ספיגה או רוויה של חמצון (Balasse et al., 1978; Balasse and Fery, 1989 ; אדמונד ואח ', 1987). ניתן למדוד בקלות חלק קטן מאוד מגופי הקטון שמקורם בכבד בשתן, ושיעורי השימוש והספיגה מחדש של הכליה הם פרופורציוניים לריכוז במחזור (גולדשטיין, 1987; רובינסון וויליאמסון, 1980). במצבים קטוטיים מאוד (> 1 מ"מ בפלזמה), קטונוריה משמשת ככתב כמותי למחצה של קטוזיס, למרות שרוב המבחנים הקליניים של גופי קטון בשתן מזהים AcAc אך לא? OHB (Klocker et al., 2013).
קטוגני מצעים והשפעתם על מטבוליזם hepatocyte
מצעים קטוגניים כוללים חומצות שומן וחומצות אמינו (איור 1B). קטבוליזם של חומצות אמינו, במיוחד לאוצין, מייצר על 4% של גופים קטון במצב שלאחר ספיגה (תומס ואח ', 1982). לפיכך, מאגר המצע של אצטיל-קוה לייצור גופי קטון נובע בעיקר מחומצות שומן, שכן במצבים של אספקת פחמימות פוחתת, pyruvate נכנס למחזור ה- TCA הכבד בעיקר באמצעות anaplerosis, כלומר, carboxylation תלויי ATP ל- oxaloacetate (OAA) (MAL), ולא דקרבווקסילציה חמצונית לאצטיל-קוא (ג 'ונג ואח', 2012, מגנוסון ואח ', 1991, מריט ואח', 2011). בכבד, גלוקוז ופירובט תורמים באופן מזערי לקטוגנזה, גם כאשר דקרבווקסילציה של pyruvate ל- acetyl-CoA היא מקסימלית (Jeoung et al., 2012).
Acetyl-CoA משתרע מספר תפקידים אינטגרלי לחילוף החומרים של הכבד מעבר לייצור ATP באמצעות חמצון סופני (ראה גם שילוב של מטבוליזם של גוף קטון, שינוי לאחר טרנסלוציאציה ופיזיולוגיה של התא). Acetyl-CoA מפעיל באופן אקוסטי (i) pyruvate carboxylase (PC), ובכך מפעיל מנגנון בקרה מטבולית המגדיל את כניסתם של מטבוליטים לתוך מחזור ה- TCA (Owen et al, 2002, Scrutton and Utter, 1967) ו- (ii) pyruvate dehydrogenase קינאז, אשר phosphorylates ומעכב deydrogenase pyruvate (PDH) (קופר ואח ', 1975), ובכך לשפר עוד יותר את זרימת pyruvate לתוך מחזור TCA באמצעות anaplerosis. יתר על כן, cytoplasmic acetyl-CoA, אשר הבריכה שלה הוא augmented על ידי מנגנונים כי להמיר אצטיל methochondrial-CoA כדי מטבוליטים ניידים, מעכב חומצת שומן חומצה: אצטיל- COA carboxylase (ACC) מזרז את ההמרה של אצטיל- CoA כדי malonyl-CoA, המצע ליפוגנית ו מעכב allosteric של מיטוכונדריה CPT1 [נסקרו ב (Kahn et al., 2005; McGarry ו פוסטר, 1980)]. לכן, המיטוכונדריאלי אצטיל- CoA הבריכה שניהם מסדיר והוא מוסדר על ידי נתיב הגלישה של קטוגנזה, אשר תזמור היבטים מרכזיים של מטבוליזם מתווך בכבד.
גורמי חילוף חומרים לא-חמצוניים של גופי קטון
הגורל השולט של קטונים הנגזרים מהכבד הוא חמצון חריג תלוי ב- SCOT. עם זאת, AcAc ניתן לייצא מיטוכונדריה ו מנוצלים במסלולים אנבוליים באמצעות המרה ACAc-COA על ידי תגובה תלויי ה- ATP מזוקק על ידי cytoplasmic acetoacetyl- סינתטיס COA (AACS, איור 1B). מסלול זה פעיל במהלך התפתחות המוח ובבלוטות החלב המניקה (מוריס, 2005, רובינסון וויליאמסון, 1978, Ohgami et al., 2003). AACS הוא גם לידי ביטוי מאוד ברקמת השומן, osteoclasts הופעל (Aguilo ואח ', 2010, Yamasaki ואח', 2016). Cytoplasmic AcAc-COA יכול להיות מכוונת על ידי cytosolic HMGCS1 לעבר biosynthesis ציטרולי, או נקרע על ידי אחד משני thiolases cytoplasmic כדי acetyl-CoA (ACAA1 ו ACAT2), carboxylated כדי malonyl-CoA, ולתרום סינתזה של חומצות שומן (ברגסטרום et , 1984, אדמונד, 1974, Endemann et al.
בעוד שהמשמעות הפיזיולוגית טרם נקבעה, קטונים יכולים לשמש מצעים אנבוליים אפילו בכבד. בהקשרים ניסיוניים מלאכותיים, AcAc יכול לתרום לכמחצית מהליפידים המסונתזים החדשים, ועד 75% מהכולסטרול החדש המסונתז (Endemann et al., 1982; Geelen et al., 1983; Freed et al., 1988). מכיוון ש- AcAc נגזר מחמצון שומן כבד לא שלם, היכולת של AcAc לתרום לליפוגנזה in vivo תרמז על רכיבה חסרת תועלת בכבד, כאשר ניתן להשתמש בקטונים שמקורם בשומן לייצור שומנים בדם, תפיסה שמשמעותה הפיזיולוגית מחייבת אימות ניסיוני, אך יכולה לשרת תפקידים אדפטיביים או לא מסתגלים (Solinas et al., 2015). AcAc מספקת בשקיקה כולסטרוגנזה, עם AACS Km-AcAc נמוך (~ 50 MM) המעדיף הפעלת AcAc גם במצב מוזן (Bergstrom et al., 1984). התפקיד הדינמי של מטבוליזם קטונים ציטופלזמי הוצע בנוירונים עובריים עכברים ראשוניים ובאדיפוציטים הנגזרים 3T3-L1, שכן מציאת AACS פגעה בבידול של כל סוג תאים (Hasegawa et al., 2012a; Hasegawa et al., 2012b). מציאת AACS בעכברים in vivo הורידה את הכולסטרול בסרום (Hasegawa et al., 2012c). SREBP-2, מווסת תעתיק ראשי לביוסינתזה של כולסטרול, וקולטן מופעל פרוקסיזום מופעל (PPAR) -? הם מפעילי תעתיק AACS, ומסדירים את תעתיקו במהלך התפתחות הנויריטים ובכבד (Aguilo et al., 2010; Hasegawa et al., 2012c). יחדיו, מטבוליזם בגוף קטון ציטופלזמי עשוי להיות חשוב בתנאים נבחרים או בהיסטוריה טבעית של מחלות, אך אינו מספיק להיפטר מגופי קטון שמקורם בכבד, שכן היפרקטונמיה מסיבית מתרחשת במסגרת פגיעה סלקטיבית בגורל החמצון הראשוני באמצעות אובדן מוטציות בתפקוד. ל- SCOT (ברי ואח ', 2001; קוטר ואח', 2011).
תקנה של HMGCS2 ו SCOT / OXCT1
ההבדלים בין המיטוכונדריה לבין הקידוד הגנטי של HMGCS, התרחשו בשלב מוקדם באבולוציה של החולייתנים בשל הצורך לתמוך בקטוגנזה בכבד במינים עם יחסי מוח גבוהים יותר למשקל הגוף (Boukaftane et al., 1994, Cunnane ו- Crawford, 2003). באופן טבעי מתרחש אובדן של תפקוד HMGCS2 מוטציות בבני אדם לגרום התקפי היפוגליקמיה hypoketotic (פיט ואח ', 2015, תומפסון ואח', 1997). ביטוי חזק של HMGCS2 מוגבל להפטוציטים ולאפיתל קולוני, והבעתו ופעילותו האנזימטית מתואמים באמצעות מנגנונים שונים (Mascaro et al., 1995, McGarry ו- Foster, 1980, רובינסון וויליאמסון, 1980). בעוד שההיקף המלא של מצבים פיזיולוגיים המשפיעים על HMGCS2 דורש הבהרה נוספת, ביטויו ו / או פעילותו מוסדרים במהלך תקופת הלידה המוקדמת, הזדקנות, סוכרת, הרעבה או בליעה של דיאטה קטוגנית (Balasse ו- Fery, 1989, Cahill GF Jr, 2006 ; Girard et al., 1992; Hegardt, 1999; Satapati et al., 2012; Sengupta et al., 2010). בעובר, מתילציה של אזור איגוף 5 של גן Hmgcs2 מתואמת באופן הפוך עם תעתיקו, והיא הפוכה חלקית לאחר הלידה (Arias et al., 1995; Ayte et al., 1993; Ehara et al., 2015; Ferre et al. ., 1983). באופן דומה, Bdh1 hepatic מציג דפוס ביטוי התפתחותי, ההולך וגדל מרגע הלידה ועד לגמילה, והוא נגרם גם על ידי דיאטה קטוגנית בגורם גידול פיברובלסטים (FGF) -21 (Badman et al., 2007, Zhang et al., 1989 ). קטוגנזה אצל יונקים מגיבה מאוד לאינסולין ולגלוקגון, מדוכאת ומעוררת, בהתאמה (McGarry ו- Foster, 1977). אינסולין מדכאת ליפוליזה של רקמת השומן, ובכך מונעת קטוגנזה של המצע שלה, בעוד שהגלוקגון מגביר את השטף הקטוגני באמצעות השפעה ישירה על הכבד (Hegardt, 1999). שעתוק Hmgcs2 מגורה על ידי גורם תעתיק forkhead FOXA2, אשר מעוכב באמצעות אינסולין-פוספטידילינוסיטול-3-kinase / Akt, והוא נגרם על ידי איתות glucagon-cAMP-p300 (Arias et al, 1995, Hegardt, 1999; Quant et al. , 1990; Thumelin et al., 1993, von Meyenn et al., 2013, Wolfrum et al., 2004, Wolfrum et al., 2003). PPAR? (Rodriguez et al., 1994) יחד עם מטרתו, FGF21 (Badman et al., 2007) גורמים לתעתיק Hmgcs2 בכבד במהלך רעב או מתן תזונה קטוגנית (Badman et al., 2007; Inagaki et al., 2007 ). אינדוקציה של PPAR? עשוי להתרחש לפני המעבר מפיזיולוגיה עוברית ליילודים, בעוד שניתן יהיה להעדיף הפעלת FGF21 בתקופת הילודים המוקדמת באמצעות עיכוב בתיווך OHB של deacetylase היסטון (HDAC) -3 (Rando et al., 2016). מעכב mTORC1 (מטרה של יונקים של קומפלקס רפמיצין 1) של PPAR? פעילות תעתיק מהווה גם מווסת מפתח לביטוי גנים Hmgcs2 (Sengupta et al., 2010), והכבד PER2, מתנד ראשי ממסד, מווסת בעקיפין את ביטוי ה- Hmgcs2 (Chavan et al., 2016). תצפיות אחרונות מצביעות על כך שאינטרלוקין -6 המושרה על ידי גידול מחוץ לכבד פוגע בקטוגנזה באמצעות PPAR? דיכוי (Flint et al., 2016).
פעילות האנזים HMGCS2 מוסדרת באמצעות מספר רב של PTM. HMGCS2 זרחון serine משופרת פעילותה במבחנה (Grimsrud et al., 2012). פעילות HMGCS2 מעכבת באופן אלסטוראלי על ידי succinyl-COA ו suysinylation ליזין ליזין (אריאס ואח ', 1995, הגארדט, 1999, Lowe ו Tubbs, 1985, Quant et al, 1990, Rardin ואח', 2013, ריד ואחרים, 1975; Thumelin ואח ', 1993). Succinylation של HMGCS2, HMGCL, ו BDH1 lysine שאריות המיטוכונדריה בכבד הם מטרות של NAD + תלוי decylase sirtuin 5 (SIRT5) (Rardin ואח ', 2013). פעילות HMGCS2 משופרת גם על ידי SycT3 deacetylation ליזין, וייתכן כי crosstalk בין acetylation ו succinylation מסדיר פעילות HMGCS2 (Rardin ואח ', 2013, Shimazu et, 2013). למרות היכולת של אלה PTMs להסדיר HMGCS2 Km ו Vmax, תנודות של אלה PTMs עדיין לא ממופה בקפידה ולא אושרו כנהגים מכניסטית של קטוגנזה in vivo.
SCOT מתבטא בכל התאים יונקים כי המיטוכונדריה הנמל, למעט אלה של hepatocytes. החשיבות של פעילות SCOT ו ketolysis הודגם עכברים SCOT-KO, אשר הציג קטלני אחיד עקב היפוגליקמיה היפוגליקמיה בתוך 48h לאחר הלידה (Cotter et al, 2011). רקמות ספציפיות של SCOT ב נוירונים או myocytes השלד גורם הפרעות מטבוליות במהלך רעב אבל הוא לא קטלני (Cotter et al., 2013b). אצל בני אדם, מחסור ב- SCOT מופיע מוקדם בחיים עם קטואסידוזיס חמור, גורם לתרדמות, הקאות ותרדמת (ברי ואח ', 2001, Fukao ואח', 2000, Kassovska-Bratinova ואח ', 1996, Niezen-Koning et al. , 1997, Saudubray ואחרים, 1987, Snyderman ואחרים, 1998, Tildon ו Cornblath, 1972). מעט יחסית ידוע ברמה התאית על גנים SCOT ו הרגולטור ביטוי חלבון. ביטוי OxctxNUMX mRNA וחלבון SCOT ופעילותם מצטמצמים במצבים קטוטיים, אולי באמצעות מנגנונים תלויי PPAR (Fenselau ו- Wallis, 1, Fenselau ו- Wallis, 1974, גרינבלט ואח ', 1976, אוקודה ואח', 1986, טורקו ואח ' ., 1991, Wentz ואח ', 2001). ב ketoacidosis סוכרתית, את חוסר התאמה בין קטוגנזה hepatic וחמצון חריגה הופך להחריף על ידי הפגיעה בפעילות SCOT. Overexpression של אינסולין עצמאית גלוקוז טרנספורטר (GLUT2010 / SLC1A2) ב cardiomyocytes גם מעכב ביטוי גנטי Oxct1 ו downregulates קטונים חמצון מסוף במצב לא קטוטי (יאן ואח ', 1). בכבד, Oxct2009 mRNA שפע הוא מדוכא על ידי microRNA-1 ו מתילציה היסטון H122K3me27, אשר ניכרים במהלך המעבר מעובר לתקופת הלידה (Thorrez et al., 3). עם זאת, דיכוי ביטוי כבד OxctXNXX בתקופה שלאחר הלידה מיוחסת בעיקר לפינוי של אבות Oxct2011- מבטאים אבות hematopoietic מהכבד, ולא הפסד של ביטוי קיים קודם Oxct1 ב hepatocytes מובחן באופן סופי. למעשה, ביטוי של mRNA Oxct1 ו SCOT חלבון hepatocytes מובחן הם נמוכים מאוד (אורי וכו ', 1).
SCOT מוסדר גם על ידי כספומטים. האנזים מצטבר יתר על המידה במוחם של עכברי SIRT3 KO, המציגים גם ייצור אצטיל-CoA תלוי ב- AcAc (Dittenhafer-Reed et al., 2015). ניטרציה לא אנזימטית של שאריות טירוזין של SCOT מחלישה גם את פעילותה, אשר דווחה בלבם של מודלים שונים של עכברים סוכרתיים (Marcondes et al., 2001; Turko et al., 2001; Wang et al., 2010a). לעומת זאת, ניטרציה של שאריות טריפטופן מגבירה את פעילות SCOT (Br g re et al., 2010; Rebrin et al., 2007). מנגנונים מולקולריים של ניטרציה או דה-ניטרציה ספציפיים לשאריות שנועדו לווסת את פעילות ה- SCOT עשויים להתקיים ודורשים בירור.
מחלוקות ב קטוגנזה אקסטרה
אצל יונקים האיבר הקטוגני העיקרי הוא כבד, ורק הפטוציטים ותאי אפיתל במעיים מבטאים בשפע את האיזופורם המיטוכונדריאלי של HMGCS2 (Cotter et al., 2013a; Cotter et al., 2014; McGarry and Foster, 1980; Robinson and Williamson, 1980) . תסיסה חיידקית אנאירובית של פוליסכרידים מורכבים מניבה בוטיראט, הנספג על ידי קולונוציטים אצל יונקים לצורך חמצון סופני או קטוגנזה (Cherbuy et al., 1995), שעשוי למלא תפקיד בבידול קולונוציטים (Wang et al., 2016). למעט תאי אפיתל במעיים והפטוציטים, HMGCS2 כמעט נעדר כמעט בכל תאי היונקים האחרים, אך הסיכוי לקטוגנזה מחוץ לכבד הועלה בתאי הגידול, באסטרוציטים של מערכת העצבים המרכזית, בכליות, בלבלב? תאים, אפיתל פיגמנט ברשתית (RPE) ואפילו בשרירי השלד (Adijanto et al., 2014; Avogaro et al., 1992; El Azzouny et al., 2016; Grabacka et al., 2016; Kang et al., 2015 ; Le Foll et al., 2014; Nonaka et al., 2016; Takagi et al., 2016a; Thevenet et al., 2016; Zhang et al., 2011). HMGCS2 חוץ רחמי נצפה ברקמות שחסרות יכולת קטוגנית נטו (Cook et al., 2016; Wentz et al., 2010), ו- HMGCS2 מציג פעילויות פוטנציאליות בלתי תלויות של קטוגנזה, "תאורת ירח", כולל בגרעין התא (Chen et al. , 2016; Kostiuk et al., 2010; Meertens et al., 1998).
לכל רקמה חוץ-כבדית המחמצנת גופי קטון יש פוטנציאל לצבור גופי קטון באמצעות מנגנונים עצמאיים של HMGCS2 (איור 2 א). עם זאת, אין רקמה אקסטרה-כבדת בה ריכוז גוף קטון במצב יציב עולה על מחזור הדם (Cotter et al., 2011; Cotter et al., 2013b; Harison and Long, 1940), ומדגיש כי גופי הקטון מועברים במורד שיפוע ריכוז באמצעות מנגנונים תלויי MCT1 / 2. מנגנון אחד של קטוגנזה חיצונית לכאורה עשוי לשקף פגיעה יחסית בחמצון הקטון. הסברים פוטנציאליים נוספים נופלים בתחום היווצרות גוף הקטון. ראשית, קטוגנזה דה נובו עשויה להתרחש באמצעות פעילות אנזימטית הפיכה של תיאולאז ו- SCOT (Weidemann and Krebs, 1969). כאשר ריכוז האצטיל-CoA גבוה יחסית, התגובות האחראיות בדרך כלל לחמצון AcAc פועלות בכיוון ההפוך (GOLDMAN, 1954). מנגנון שני מתרחש כאשר ביניים הנגזרים מ- חמצון מצטברים עקב צוואר בקבוק של מחזור TCA, AcAc-CoA מומר ל- l-? OHB-CoA באמצעות תגובה מזרזת על ידי המידוכונדריה 3-hydroxyacyl-CoA dehydrogenase, ובהמשך על ידי 3-hydroxybutyryl CoA deacylase ל- l-? OHB, שלא ניתן להבחין בספקטרומטר מסה או בספקטרוסקופיית תהודה מהאננטיומר הפיזיולוגי d-? OHB (ריד ואוזנד, 1980). ניתן להבדיל כרומטוגרפית או אנזימטית בין l-? OHB, והוא קיים ברקמות חוץ-כבדיות, אך לא בכבד או בדם (Hsu et al., 2011). קטוגנזה בכבד מייצרת רק d-? OHB, האננטיומר היחיד שהוא מצע BDH (Ito et al., 1984; Lincoln et al., 1987; Reed and Ozand, 1980; Scofield et al., 1982; Scofield et al., 1982). מנגנון שלישי שאינו תלוי ב- HMGCS2 מייצר d-? OHB באמצעות קטבוליזם של חומצות אמינו, במיוחד זה של לאוצין וליזין. מנגנון רביעי ניכר רק מכיוון שהוא נובע מחפץ תיוג ולכן מכונה פסאודוקטוגנזה. תופעה זו נובעת מהפיכותם של תגובות SCOT ותיולאז, ועלולה לגרום להערכת יתר של מחזור גוף הקטון עקב דילול איזוטופי של נותב גופני קטון ברקמות חוץ-כבדיות (Des Rosiers et al., 1990; Fink et al., 1988). . עם זאת, פסאודוקטוגנזה עשויה להיות זניחה ברוב ההקשרים (Bailey et al., 1990; Keller et al., 1978). סכמטי (איור 2 א ') מציין גישה שימושית ליישום תוך התחשבות בריכוז מוגבר של יציבות של קטונים.
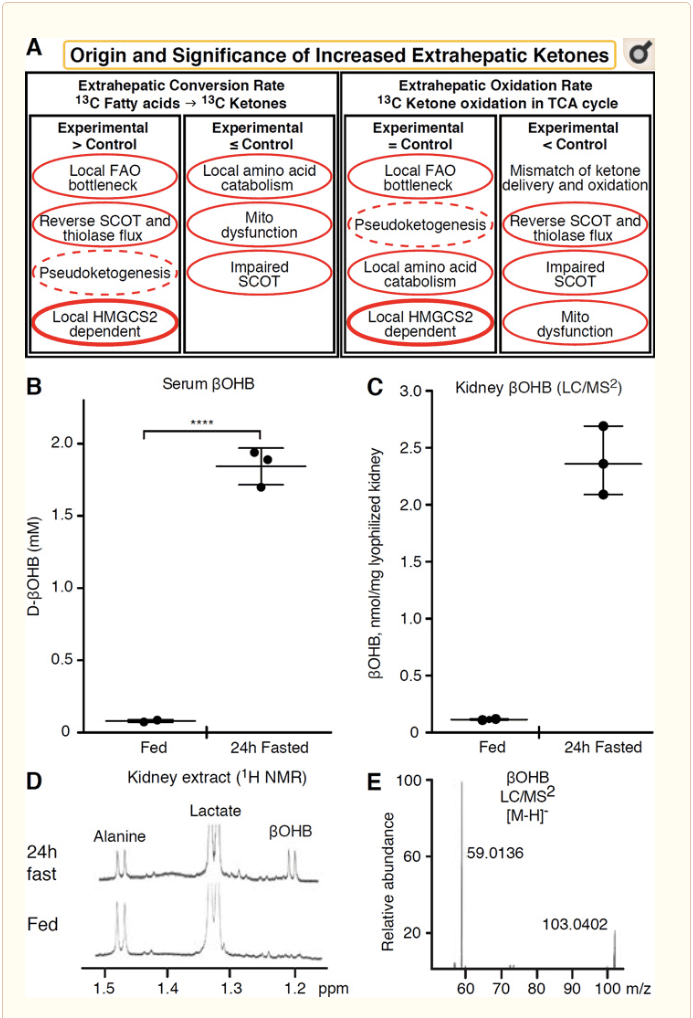

הכליה קיבלה לאחרונה תשומת לב כאיבר קטוגני. ברוב המוחלט של המדינות, הכליה היא צרכן נטו של גופי קטון שמקורם בכבד, ומפריש או מגלם מחדש גופי קטון מזרם הדם, וכליות בדרך כלל אינן מחולל גוף או קטנטו לגוף קטון (רובינסון וויליאמסון, 1980). מחברי המחקר הקלאסי הגיעו למסקנה כי קטוגנזה מינימאלית של הכליה בכימות במערכת ניסוי מלאכותית אינה רלוונטית מבחינה פיזיולוגית (Weidemann and Krebs, 1969). לאחרונה, קטוגנזה כלייתית הוסברה במודלים של עכברים חסרי סוכרת ואוטופאגיה, אך סביר יותר כי שינויים מרובי איברים בהומאוסטזיס מטבולי משנים את חילוף החומרים של הקטון האינטגרטיבי באמצעות תשומות באיברים מרובים (Takagi et al., 2016a; Takagi et al., 2016b; ג'אנג ואח ', 2011). פרסום אחד האחרון הציע קטוגנזה כלייתית כמנגנון מגן מפני פגיעת איסכמיה-רפרפוזיה בכליה (Tran et al., 2016). ריכוזי מצב יציב מוחלטים של? OHB מתמציות של רקמת כליה של עכברים דווחו ב- ~ 4 מ"מ. כדי לבדוק אם זה היה בר קיימא, כימתנו את ריכוזי OHB בתמציות כליה מעכברים שנאכלו וצמו 12 שעות. ריכוזי OHB בסרום עלו מ ~ 24 מ"מ ל -100 מ"מ עם צום 2 שעות (איור 24 ב), בעוד שמצב יציב כלייתי? ריכוזי OHB בערך 2 מ"מ במצב האכלה, ורק 100 מ"מ במצב צום 1 שעות (איור 24C E), תצפיות העולות בקנה אחד עם הריכוזים שנכמתו לפני למעלה מ 2 שנה (המס וברוסנן, 45). זה אפשרי שבמצבים קטוטיים, גופי קטון שמקורם בכבד יכולים להיות מוגנים מחדש, אך עדויות לקטוגנזה כלייתית דורשות ביסוס נוסף. עדויות משכנעות התומכות בקטוגנזה חוץ-hepatic אמיתית הוצגו ב- RPE (Adijanto et al., 1970). הוצע טרנספורמציה מטבולית מסקרנת זו שאפשרה לאפשר לקטונים שמקורם ב- RPE לזרום לתאי קולטי אור או לתאי גליה מולר, אשר יכולים לסייע בהתחדשות הקטע החיצוני של קולטי האור.
? OHB כמתווך איתות
למרות שהם עשירים אנרגטית, גופי קטון מפעילים תפקידי איתות "לא-קנוניים" פרובוקטיביים בהומאוסטזיס הסלולרי (איור 3) (Newman and Verdin, 2014; Rojas-Morales et al., 2016). לדוגמא,? OHB מעכב HDACs מסוג I, מה שמגביר את האצטילציה של ההיסטון ובכך גורם לביטוי של גנים שמצמצמים את הלחץ החמצוני (Shimazu et al., 2013). OHB עצמו מהווה שינוי קוולנטי היסטוני בשאריות ליזין בכבד של עכברים סוכרתיים בצום או בסטרפטוזוטוצין (Xie et al., 2016) (ראה גם להלן, שילוב מטבוליזם בגוף הקטון, שינוי לאחר תרגום ופיזיולוגיה של תאים, וכן גופי קטון, לחץ חמצוני והגנה עצבית).
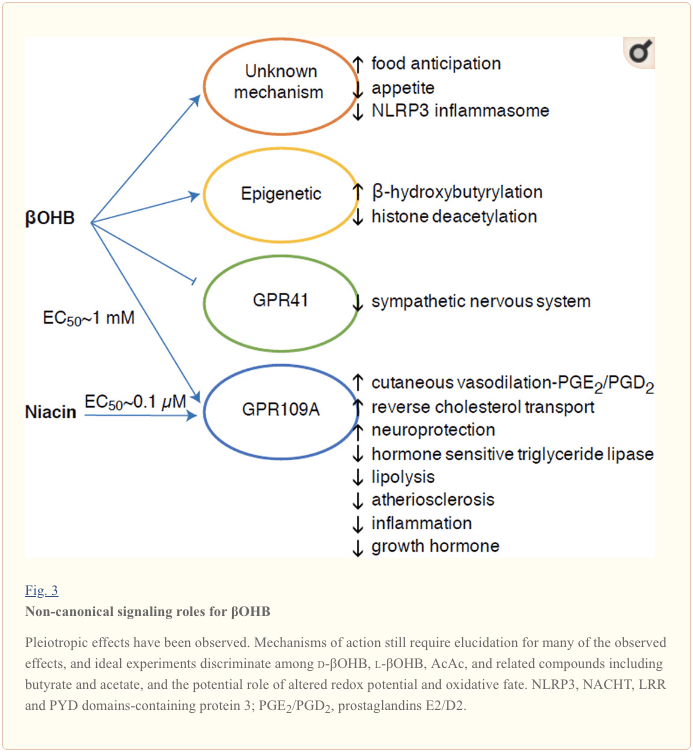
OHB הוא גם אפקטור באמצעות קולטנים מצמידים לחלבון G. באמצעות מנגנונים מולקולריים לא ברורים, הוא מדכא את פעילות מערכת העצבים הסימפתטית ומפחית את הוצאת האנרגיה הכוללת ואת קצב הלב על ידי עיכוב איתות חומצות שומן קצרות שרשרת דרך קולטן מצויד לחלבון G 41 (GPR41) (Kimura et al., 2011). אחת מתופעות האיתות הנחקרות ביותר של? OHB ממשיכה באמצעות GPR109A (הידוע גם בשם HCAR2), בן למשפחת המשנה GPCR של חומצה הידרוקרבוקסילית המתבטא ברקמות שומן (לבן וחום) (Tunaru et al., 2003), וב- תאים חיסוניים (אחמד ואח ', 2009). OHB הוא הליגנד האנדוגני היחיד הידוע של קולטן GPR109A (EC50 ~ 770 MM) המופעל על ידי d-? OHB, l-? OHB ובוטיראט, אך לא AcAc (Taggart et al., 2005). סף הריכוז הגבוה להפעלת GPR109A מושג באמצעות הקפדה על תזונה קטוגנית, רעב או במהלך קטואצידוזיס, מה שמוביל לעיכוב של ליפוליזת רקמת השומן. ההשפעה האנטי-ליפוליטית של GPR109A ממשיכה בעיכוב של אדניליל ציקלאז וירידה ב- cAMP, ומעכבת ליפאז טריגליצריד רגיש להורמונים (Ahmed et al., 2009; Tunaru et al., 2003). זה יוצר לולאת משוב שלילית בה קטוזיס מציב בלם מודולרי על הקטוגנזה על ידי צמצום שחרורן של חומצות שומן לא אסטרליות מאדיפוציטים (Ahmed et al., 2009; Taggart et al., 2005), השפעה שניתן לאזן באמצעות הדחף הסימפטי שמעורר ליפוליזה. ניאצין (ויטמין B3, חומצה ניקוטינית) הוא ליגנד חזק (EC50 ~ 0.1 MM) ל- GRP109A, שהופעל ביעילות במשך עשרות שנים לדיסליפידמיה (Benyo et al., 2005; Benyo et al., 2006; Fabbrini et al., 2010a; לוקאסובה ואח ', 2011; טונארו ואח', 2003). בעוד שניאצין משפר את הובלת הכולסטרול ההפוך במקרופאגים ומפחית נגעים טרשת עורקים (Lukasova et al., 2011), ההשפעות של OHB על נגעים טרשת עורקים נותרו לא ידועות. למרות שקולטן GPR109A ממלא תפקידי מגן, וקיימים קשרים מסקרנים בין שימוש בדיאטה קטוגנית בשבץ מוחי למחלות ניווניות (Fu et al., 2015; Rahman et al., 2014), תפקיד מגן של? OHB באמצעות GPR109A לא הוכח in vivo .
לבסוף,? OHB עשוי להשפיע על התיאבון והשובע. מטא-אנליזה של מחקרים שמדדה את ההשפעות של דיאטות קטוגניות ואנרגיה נמוכה מאוד הגיעה למסקנה שהמשתתפים הצורכים דיאטות אלה מציגים שובע גבוה יותר בהשוואה לדיאטות בקרה (Gibson et al., 2015). עם זאת, הסבר מתקבל על הדעת להשפעה זו הוא האלמנטים המטבוליים או ההורמונלים הנוספים שעשויים לווסת את התיאבון. לדוגמא, עכברים שנשמרו על דיאטה קטוגנית של מכרסמים הציגו הוצאות אנרגיה מוגברות בהשוואה לעכברים המוזנים בשליטה, למרות צריכת קלוריות דומה, ולפטין במחזור או גנים של פפטידים המסדירים את התנהגות האכלה לא שונו (Kennedy et al., 2007). בין המנגנונים המוצעים המציעים דיכוי תיאבון על ידי? OHB כולל גם איתות וגם חמצון (Laeger et al., 2010). מחיקה ספציפית של הפטוציטים של גן קצב היממה (Per2) ומחקרי חיסון של כרומטין החיסון גילה כי PER2 מפעיל ישירות את הגן Cpt1a, ומווסת בעקיפין את Hmgcs2, מה שמוביל לקטוזיס לקוי בעכברי נוקאאוט Per2 (Chavan et al., 2016). עכברים אלה הציגו ציפייה לקויה למזון, ששוחזרה חלקית על ידי ניהול מערכת OHB מערכתית. יש צורך במחקרים עתידיים בכדי לאשר את מערכת העצבים המרכזית כיעד ישיר של OHB והאם נדרשת חמצון קטון להשפעות שנצפו, או שמדובר במנגנון איתות אחר. חוקרים אחרים העלו את האפשרות לקטוגנזה מקומית שמקורם באסטרוציטים בתוך ההיפותלמוס המזרחי כווסת צריכת מזון, אך תצפיות ראשוניות אלה גם ייהנו מהערכות גנטיות ומבוססות על שטף (Le Foll et al., 2014). הקשר בין קטוזיס למחסור בחומרים מזינים נותר מעניין מכיוון שרעב ושובע הם אלמנטים חשובים בניסיונות הרזיה כושלים.
שילוב של מטבוליזם של גוף קטון, שינוי פוסט-טרנסלציוני ופיזיולוגיה של התא
גופי Ketone לתרום בריכות ממודרות של אצטיל- CoA, ביניים ביניים המציג תפקידים בולטים בחילוף החומרים הסלולר (Pietrocola et al., 2015). תפקיד אחד של acetyl-CoA הוא לשמש מצע עבור acetylation, שינוי היסטלי אנזימטלי היסטון קוולנטי שינוי (Choudhary et al., 2014, Dutta ואח ', 2016, מניפה וכו', 2015, Menzies ואח ', 2016 ). מספר רב של חלבונים מיטוכונדריאליים דינמיים, רבים מהם עשויים להתרחש באמצעות מנגנונים לא אנזימטיים, צמחו גם ממחקרי פרוטאומיקה חישובית (Dittenhafer-Reed et al., 2015; Hebert et al., 2013; Rardin et al., 2013 ; Shimazu ואח ', 2010). Dacetylases ליזין להשתמש cofactor אבץ (למשל, nucleocytosolic HDACs) או NAD + כמו מצע שיתוף (sirtuins, SIRTs) (Choudhary ואחרים, 2014, Menzies ואח ', 2016). Acetylproteome משמש גם חיישן ו effector של כלל אצטיל סלולר הבריכה COA, כמו מניפולציות פיזיולוגיות וגנטיות כל תוצאה של וריאציות לא אנזימטיות העולמי של acetylation (Weinert et al., 2014). כמו מטבוליטים תאיים לשמש מאפננים של acetylation שאריות ליזין, חשוב לשקול את התפקיד של גופי קטון, אשר שפע דינמי מאוד.
OHB הוא שינוי אפיגנטי באמצעות שני מנגנונים לפחות. רמות OHB מוגברות הנגרמות על ידי צום, הגבלה קלורית, ניהול ישיר או פעילות גופנית ממושכת מעוררות עיכוב HDAC או הפעלת היסטיל אצטילטרנספרז (Marosi et al., 2016; Sleiman et al., 2016) או למתח חמצוני (Shimazu et al., 2013) . עיכוב OHB של HDAC3 יכול לווסת את הפיזיולוגיה המטבולית של הילוד (Rando et al., 2016). באופן עצמאי,? OHB עצמו משנה ישירות את שאריות הליזין של ההיסטון (Xie et al., 2016). צום ממושך, או קטטואצידוזיס סוכרתית המושרה על ידי סטפטוזוטוצין הגבירו את ההיסטון? -הידרוקסי בוטירילציה. למרות שמספר האתרים של ליזין? -הידרוקסיביוטילציה ואצטילציה היה דומה, נצפתה היסטו-א-הידרוקסיביוטרילציה גדולה יותר מבאצטילציה. גנים מובחנים הושפעו מליזין היסטון לי-הידרוקסיבוטי, לעומת אצטילציה או מתילציה, דבר המצביע על פונקציות תאיות מובהקות. האם לא ידוע אם -Hydroxybutyrylation הוא ספונטני או אנזימטי, אך מרחיב את טווח המנגנונים באמצעות גופי קטון המשפיעים באופן דינמי על התעתיק.
ניתן לתווך אירועי תכנות חיוניים של תאים במהלך הגבלה קלורית ומחסור בחומרים תזונתיים ב- SIRT3 ו- SIRT5 תלויים בדה-דסצילציה ודיסוצינילציה של המיטוכונדריה, בהתאמה, תוך ויסות חלבונים קטוגניים וקטוליטיים ברמה שלאחר טרנסלוקציה ברקמות כבד ורקמות חוץ (Dittenhafer-Reed et al., 2015; Hebert et al., 2013; Rardin et al., 2013; Shimazu et al., 2010). למרות שהשוואה סטויוכיומטרית של אתרים תפוסים לא בהכרח מתקשרת ישירות לתזוזה בשטף חילוף החומרים, אצטילציה של המיטוכונדריה היא דינמית ועשויה להיות מונעת על ידי ריכוז אצטיל-CoA או pH מיטוכונדריאלי, ולא על ידי אצטיל-טרנספרזות אנזימטיות (Wagner and Payne, 2013). SIRT3 ו- SIRT5 מווסתים פעילויות של אנזימים המטבוליזם בגוף הקטון, מעוררים את שאלת תפקידם ההדדי של קטונים בפיסול האצטיל-פרוטאום, הסוצ'ניל-פרוטאום ומטרות תאיות דינמיות אחרות. ואכן, כאשר וריאציות של קטוגנזה משקפות ריכוזי NAD +, ייצור קטון ושפע יכולים לווסת את פעילות הסירטואין, ובכך להשפיע על סך בריכות האצטיל-CoA / succinyl-CoA, האציל-פרוטאום, ובכך פיזיולוגיה של המיטוכונדריה והתאים. ייצור הידרוקסיבוטרי של שאריות אנזים ליזין יכול להוסיף שכבה נוספת לתכנות מחדש של התא. ברקמות מחוץ לכבד, חמצון בגוף הקטון עשוי לעורר שינויים אנלוגיים בהומאוסטזיס התא. בעוד שתא של בריכות אצטיל-CoA מווסת מאוד ומתאם ספקטרום רחב של שינויים תאיים, יכולתם של גופי קטון לעצב באופן ישיר את ריכוזי האצטיל-CoA המיטוכונדריאליים והציטופלזמיים דורשת בירור (Chen et al., 2012; Corbet et al., 2016; Pougovkina et al., 2014; Schwer et al., 2009; Wellen and Thompson, 2012). מכיוון שריכוזי האצטיל-CoA מווסתים היטב, ואצטיל-CoA הוא ממברנה, חשוב לשקול את מנגנוני הנהג המתאמים את ההומאוסטזיס של אצטיל-CoA, כולל שיעורי הייצור וחמצון סופני במחזור TCA, המרה לגופי קטון, מיטוכונדריה זרם באמצעות קרניטין אצטיל-טרנספרז (CrAT), או ייצוא אצטיל-CoA לציטוזול לאחר המרה לציטראט ושחרור על ידי ATP ציטראט ליאז (ACLY). תפקידי המפתח של מנגנונים אלה בתאי אצטיל פרוטאום ובהומאוסטזיס דורשים הבנה תואמת של תפקידי הקטוגנזה וחמצון הקטונים (Das et al., 2015; McDonnell et al., 2016; Moussaieff et al., 2015; Overmyer et al., 2015; Seiler et al., 2014; Seiler et al., 2015; Wellen et al., 2009; Wellen and Thompson, 2012). טכנולוגיות מתכנסות במטבולומיקה ובאצטיל פרוטאומיקה בקביעת מודלים עם מניפולציה גנטית יידרשו לציין מטרות ותוצאות.
תגובות אנטי-פרו-דלקתיות לגופי קטון
קטוזיס וגופי קטון מווסתים דלקת ותפקוד תאים חיסוניים, אך הוצעו מנגנונים מגוונים ואפילו לא מתאימים. מחסור בחומרים מזינים ממושכים מפחית דלקת (Youm et al., 2015), אך הקטוזיס הכרוני של סוכרת מסוג 1 הוא מצב פרו-דלקתי (Jain et al., 2002; Kanikarla-Marie and Jain, 2015; Kurepa et al., 2012 ). תפקידי איתות מבוססי מנגנון עבור? OHB בדלקת מופיעים מכיוון שתאי מערכת חיסונית רבים, כולל מקרופאגים או מונוציטים, מבטאים בשפע את GPR109A. בעוד ש- OHB מפעיל תגובה אנטי-דלקתית ברובה (Fu et al., 2014; Gambhir et al., 2012; Rahman et al., 2014; Youm et al., 2015), ריכוזים גבוהים של גופי קטון, במיוחד AcAc, עשויים להיות. לעורר תגובה פרו-דלקתית (Jain et al., 2002; Kanikarla-Marie and Jain, 2015; Kurepa et al., 2012).
נבדקו תפקידים אנטי דלקתיים של ליגנדים GPR109A בטרשת עורקים, השמנת יתר, מחלות מעי דלקתיות, מחלות נוירולוגיות וסרטן (Graff et al., 2016). ביטוי GPR109A מוגבר בתאי RPE של מודלים סוכרתיים, חולי סוכרת אנושיים (Gambhir et al., 2012) ובמיקרוגליה במהלך ניוון עצבי (Fu et al., 2014). השפעות אנטי דלקתיות של? OHB משופרות על ידי ביטוי יתר של GPR109A בתאי RPE, ובוטלות על ידי עיכוב תרופתי או נוקאאוט גנטי של GPR109A (Gambhir et al., 2012). OHB וחומצה ניקוטינית אקסוגנית (Taggart et al., 2005), שניהם מקנים השפעות אנטי דלקתיות ב- TNF? או דלקת המושרה על ידי LPS על ידי הפחתת רמות החלבונים הפרו-דלקתיים (iNOS, COX-2), או ציטוקינים המופרשים (TNF ?, IL-1 ?, IL-6, CCL2 / MCP-1), בין השאר באמצעות עיכוב NF -? B טרנסלוקציה (Fu et al., 2014; Gambhir et al., 2012). OHB מפחית את מתח ה- ER ואת הדלקת NLRP3, ומפעיל את תגובת הלחץ האנטי-חמצונית (Bae et al., 2016; Youm et al., 2015). עם זאת, בדלקת ניוונית ניוונית, הגנה בתיווך OHR תלויה ב- GPR109A אינה כוללת מתווכים דלקתיים כמו איתות מסלול MAPK (למשל ERK, JNK, p38) (Fu et al., 2014), אך עשויה לדרוש COG-1 תלוי ב- PGD2 הפקה (רחמן ואח ', 2014). מסקרן כי נדרשת מקרופאג GPR109A להפעלת אפקט נוירו-מגן במודל שבץ מוחי איסכמי (Rahman et al., 2014), אך יכולתו של? OHB לעכב את דלקת ה- NLRP3 במקרופאגים הנגזרים ממוח העצם אינה תלויה ב- GPR109A (Youm et al. ., 2015). למרות שרוב המחקרים מקשרים בין? OHB להשפעות אנטי דלקתיות,? OHB עשוי להיות פרו דלקתי ולהגדיל סמנים של חמצון ליפידים בהפטוציטים של עגלים (Shi et al., 2014). השפעות אנטי-מול-דלקתיות של? OHB עשויות להיות תלויות בסוג התאים, בריכוז OHB, משך החשיפה ובנוכחותם או היעדרם של קואמפולטורים.
שלא כמו? OHB, AcAc עשוי להפעיל איתות פרו-דלקתי. AcAc מוגבר, במיוחד עם ריכוז גלוקוז גבוה, מעצים את הפגיעה בתאי האנדותל באמצעות מנגנון תלוי מתח אוקסידאז / NADPH (Kanikarla-Marie and Jain, 2015). ריכוזי AcAc גבוהים בחבל הטבור של אמהות סוכרתיות היו בקורלציה עם קצב חמצון חלבונים גבוה יותר וריכוז MCP-1 (Kurepa et al., 2012). AcAc גבוה בקרב חולי סוכרת היה בקורלציה עם TNF? ביטוי (Jain et al., 2002) ו- AcAc, אך לא? OHB, הביא ל- TNF ?, ביטוי MCP-1, הצטברות ROS, וירידה ברמת cAMP בתאי מונוציטים אנושיים U937 (Jain et al., 2002; Kurepa et al. ., 2012).
תופעות איתות תלויות גוף קטון מופעלות לעיתים קרובות רק בריכוזי גוף גבוהים של קטון (> 5 מ"מ), ובמקרה של מחקרים רבים שקושרים קטונים להשפעות פרו-או אנטי-דלקתיות, באמצעות מנגנונים לא ברורים. בנוסף, בשל ההשפעות הסותרות של? OHB לעומת AcAc על דלקת, והיכולת של יחס AcAc /? OHB להשפיע על פוטנציאל החמצון המיטוכונדריאלי, הניסויים הטובים ביותר להערכת התפקידים של גופי קטון על פנוטיפים תאיים משווים את ההשפעות של AcAc ו-? OHB ביחסים משתנים ובריכוזים מצטברים משתנים [למשל (Saito et al., 2016)]. לבסוף, ניתן לרכוש AcAc באופן מסחרי רק כמלח ליתיום או כאסתר אתילי הדורש הידרוליזה בסיסית לפני השימוש. קטיון ליתיום גורם באופן עצמאי למפל התמרה של אותות (Manji et al., 1995), ואניון AcAc הוא יציב. לבסוף ניתן לבלבל מחקרים המשתמשים ב- d / l-? OHB, מכיוון שרק ה- stereoisomer d-? OHB יכול להתחמצן ל- AcAc, אך d-? OHB ו- l-? OHB יכולים לאותת באמצעות GPR109A, לעכב את הדלקת NLRP3, ומשמשים מצעים ליפוגניים.
גופי קטון, מתח חמצוני ונוירופרוטקציה
מתח חמצוני מוגדר בדרך כלל כמצב בו ROS מוצג עודף, בגלל ייצור מוגזם ו / או חיסול לקוי. תפקידים מקלים על נוגדי חמצון ומתח חמצוני של גופי קטון תוארו באופן נרחב הן במבחנה והן ב- vivo, במיוחד בהקשר של הגנה עצבית. מכיוון שרוב הנוירונים אינם מייצרים ביעילות פוספטים בעלי אנרגיה גבוהה מחומצות שומן, אך הם מחמצנים את גופי הקטון כאשר הפחמימות חסרות, השפעות נוירו-מגן של גופי הקטון חשובות במיוחד (Cahill GF Jr, 2006; Edmond et al., 1987; Yang ואח ', 1987). במודלים של מתח חמצוני, אינדוקציה של BDH1 ודיכוי SCOT מצביעים על כך שניתן לתכנת מחדש את חילוף החומרים בגוף הקטון בכדי לקיים איתותים מגוונים של תאים, פוטנציאל החמצון או דרישות מטבוליות (Nagao et al., 2016; Tieu et al., 2003).
גופי קטון מפחיתים את דרגות הנזק הסלולרי, פציעה, מוות ואפופטוזיס תחתון בנוירונים ובקרדיומיוציטים (Haces et al., 2008; Maalouf et al., 2007; Nagao et al., 2016; Tieu et al., 2003). המנגנונים המופעלים מגוונים ולא תמיד קשורים באופן לינארי לריכוז. ריכוזים מילימולריים נמוכים של (d או l) -? OHB scovenge ROS (אניון הידרוקסיל), בעוד ש- AcAc מסלק מינים רבים של ROS, אך רק בריכוזים העולים על הטווח הפיזיולוגי (IC50 20 mM) (Haces et al., 67) . לעומת זאת, השפעה מועילה על פוטנציאל החיזור של שרשרת האלקטרונים היא מנגנון המקושר בדרך כלל ל- d-? OHB. בעוד שכל שלושת גופי הקטון (d / l-? OHB ו- AcAc) הפחיתו את מוות התאים העצביים ואת הצטברות ה- ROS המופעלת על ידי עיכוב כימי של גליקוליזה, רק d-? OHB ו- AcAc מנעו ירידה ב- ATP עצבית. לעומת זאת, במודל היפוגליקמי in vivo, (d או l) -? OHB, אך לא AcAc מנע את חמצון השומנים בהיפוקמפוס (Haces et al., 2008; Maalouf et al., 2008; Marosi et al., 2007; Murphy, 2016 ; Tieu et al., 2009). מחקרי in vivo של עכברים שניזונו מתזונה קטוגנית (2003% שומן בקק"ל ו -87% חלבון) הציגו וריאציה נוירו-אנטומית של יכולת נוגדת חמצון (Ziegler et al., 13), שם נצפו השינויים העמוקים ביותר בהיפוקמפוס, עם עליית גלוטתיון פרוקסידאז ובסך הכל. יכולות נוגדות חמצון.
תזונה קטוגנית, אסטרים של קטונים (ראו גם שימוש טיפולי בתזונה קטוגנית ובגופי קטון אקסוגניים), או במתן OHB מגן על הגנה עצבית במודלים של שבץ איסכמי (Rahman et al., 2014); מחלת פרקינסון (Tieu et al., 2003); התקף רעילות חמצן במערכת העצבים המרכזית (D'Agostino et al., 2013); עוויתות אפילפטיות (Yum et al., 2015); אנצפלומיופתיה מיטוכונדריאלית, חומצה לקטית ותסמונת פרקים דמויי שבץ מוחי (MELAS) (Frey et al., 2016) ומחלת אלצהיימר (Cunnane and Crawford, 2003; Yin et al., 2016). לעומת זאת, דוח שנערך לאחרונה הוכיח עדויות היסטופתולוגיות להתקדמות ניוונית על ידי תזונה קטוגנית במודל עכבר מהונדס של תיקון DNA מיטוכונדריאלי חריג, למרות עלייה בביוגנזה של המיטוכונדריה וחתימות נוגדות חמצון (Lauritzen et al., 2016). דיווחים סותרים אחרים מצביעים על כך שחשיפה לריכוזי גוף גבוהים של קטון מעוררת מתח חמצוני. מינונים גבוהים של OHB או AcAc גרמו להפרשת תחמוצת החנקן, חמצון שומנים בדם, ביטוי מופחת של SOD, גלוטתיון פרוקסידאז וקטלאז בהפטוציטים של עגל, ואילו בהפטוציטים של חולדות, אינדוקציה של מסלול MAPK יוחסה ל- AcAc אך לא ל- OHB (Abdelmegeed et al., 2004) ; שי ואח ', 2014; שי ואח', 2016).
יחדיו, רוב הדיווחים מקשרים בין OHB לירידת מתח חמצוני, שכן מתן מעכב ייצור ROS / סופר-חמצני, מונע חמצון ליפידים וחמצון חלבון, מגביר את רמות החלבון נוגדי החמצון ומשפר את הנשימה המיטוכונדריאלית ואת ייצור ה- ATP (Abdelmegeed et al., 2004; Haces et al., 2008; Jain et al., 1998; Jain et al., 2002; Kanikarla-Marie and Jain, 2015; Maalouf et al., 2007; Maalouf and Rho, 2008; Marosi et al., 2016; Tieu ואח ', 2003; יין ואח', 2016; זיגלר ואח ', 2003). בעוד ש- AcAc נמצא בקורלציה ישירה יותר מ- OHB עם אינדוקציה של מתח חמצוני, לא תמיד תופעות אלו מנותחות בקלות מתגובות פרו-דלקתיות פוטנציאליות (Jain et al., 2002; Kanikarla-Marie and Jain, 2015; Kanikarla-Marie and ג'יין, 2016). יתר על כן, קריטי לשקול כי התועלת האנטי-אוקסידנטית לכאורה שמקנה דיאטות קטוגניות פלאי-טרופיות עשויה שלא להיות מועברת על ידי גופי קטון עצמם, והגנה עצבית המוענקת על ידי גופי קטון עשויה שלא להיות מיוחסת לחלוטין למתח חמצוני. לדוגמא במהלך מחסור בגלוקוז, במודל של מחסור בגלוקוז בתאי עצב בקליפת המוח,? OHB עורר שטף אוטופגי ומנע הצטברות אוטופגוזום, שהיה קשור לירידה במוות עצבי (Camberos-Luna et al., 2016). d-? OHB גורם גם לחלבונים נוגדי חמצון קנוניים FOXO3a, SOD, MnSOD ו- catalase, באופן פרוספקטיבי באמצעות עיכוב HDAC (Nagao et al., 2016; Shimazu et al., 2013).
מחלת כבד כבד לא-אלכוהולית (NAFLD) ומטבוליזם של גוף קטון
NAFLD הקשורים להשמנה וסטאטהפטיטיס לא אלכוהולי (NASH) הם הגורמים השכיחים ביותר למחלות כבד במדינות המערב (Rinella and Sanyal, 2016), ואי ספיקת כבד הנגרמת על ידי NASH היא אחת הסיבות השכיחות ביותר להשתלת כבד. בעוד שאחסון עודף של טריאצילגליצרולים בהפטוציטים> 5% ממשקל הכבד (NAFL) בלבד אינו גורם לתפקוד כבד ניווני, ההתקדמות ל- NAFLD בבני אדם מתואמת עם עמידות מערכתית לאינסולין ועלייה בסיכון לסוכרת מסוג 2, ועשויה לתרום לפתוגנזה של מחלות לב וכלי דם ומחלות כליות כרוניות (Fabbrini et al., 2009; Targher et al., 2010; Targher and Byrne, 2013). המנגנונים הפתוגניים של NAFLD ו- NASH אינם מובנים לחלוטין אך כוללים הפרעות בחילוף החומרים של הפטוציטים, אוטופאגיה של הפטוציטים ומתח של הרשתית האנדופלזמית, תפקוד תאי החיסון בכבד, דלקת ברקמת השומן ומגשרים דלקתיים מערכתיים (Fabbrini et al., 2009; Masuoka ו- Chalasani, 2013 ; Targher et al., 2010; Yang et al., 2010). הפרעות במטבוליזם של פחמימות, ליפידים וחומצות אמיניות מתרחשות ותורמות להשמנה, סוכרת ו- NAFLD בבני אדם ובאורגניזמים מודליים [נבדקו ב- (Farese et al., 2012; Lin and Accili, 2011; Newgard, 2012; Samuel and שולמן, 2012; סאן ולזר, 2013)]. בעוד שחריגות הפטוציטים בחילוף החומרים השומני הציטופלזמי נצפות בדרך כלל ב- NAFLD (Fabbrini et al., 2010b), תפקיד מטבוליזם המיטוכונדריה, השולט בסילוק חמצוני של שומנים, פחות ברור בפתוגנזה של NAFLD. חריגות של חילוף החומרים המיטוכונדריה מתרחשות בפתוגנזה של NAFLD / NASH (Hyotylainen et al., 2016; Serviddio et al., 2011; Serviddio et al., 2008; Wei et al., 2008). יש כללי (Felig et al., 1974; Iozzo et al., 2010; Koliaki et al., 2015; Satapati et al., 2015; Satapati et al., 2012; Sunny et al., 2011) אבל לא אחיד ( קוליאקי ורודן, 2013; פרי ואח ', 2016; רקטור ואח', 2010) הסכמה כי לפני התפתחות NASH בתום לב, חמצון מיטוכונדריאלי בכבד, ובמיוחד חמצון שומן, מתוגבר בהשמנת יתר, עמידות לאינסולין מערכתית. , ו- NAFLD. סביר להניח שככל שמתקדמת NAFLD, הופעת ההטרוגניות של יכולת חמצון, אפילו בקרב המיטוכונדריה הפרטנית, ובסופו של דבר תפקוד החמצון נפגע (Koliaki et al., 2015; Rector et al., 2010; Satapati et al., 2008; Satapati et al. ., 2012).
קטוגנזה משמשת לעתים קרובות כפרוקסי לחמצון שומן בכבד. ליקויים בקטוגנזה מתגלים ככל שמתקדמת NAFLD במודלים של בעלי חיים, וסביר להניח שבבני אדם. באמצעות מנגנונים שהוגדרו לחלוטין, היפר-אינסולינמיה מדכא קטוגנזה, ואולי תורם להיפוקטונמיה בהשוואה לבקרות רזות (Bergman et al., 2007; Bickerton et al., 2008; Satapati et al., 2012; Soeters et al., 2009; Sunny et al. , 2011; סגן ואח ', 2005). עם זאת, היכולת של מחזורי ריכוזי קטון בגוף לחזות NAFLD שנויה במחלוקת (Mnnist et al., 2015; Sanyal et al., 2001). שיטות ספקטרוסקופיות כמותיות חזקות של תהודה מגנטית במודלים של בעלי חיים גילו שיעור מוגבר של מחזור הקטון עם עמידות מתונה לאינסולין, אך שיעורי ירידה ניכרו עם עמידות חמורה יותר לאינסולין (Satapati et al., 2012; Sunny et al., 2010). בבני אדם שמנים עם כבד שומני, שיעור הקטוגני הוא תקין (Bickerton et al., 2008; Sunny et al., 2011), ומכאן, שיעורי הקטוגנזה פחתים ביחס לעומס מוגבר של חומצות השומן בתוך הפטוציטים. כתוצאה מכך, אצטיל-CoA הנגזר מ- חמצון עשוי להיות מופנה לחמצון סופני במחזור TCA, להגברת החמצון הסופי, גלוקונאוגנזה מונע על ידי פוספואנולפירואט באמצעות אנפלרוזיס / קטפלרוזיס ומתח חמצוני. Acetyl-CoA עשוי גם לעבור ייצוא ממיטוכונדריה כציטראט, מצע מבשר לליפוגנזה (איור 4) (Satapati et al., 2015; Satapati et al., 2012; Solinas et al., 2015). בעוד שהקטוגנזה הופכת פחות תגובה לאינסולין או לצום עם השמנת יתר ממושכת (Satapati et al., 2012), המנגנונים הבסיסיים וההשלכות במורד הזרם של זה נותרו מובנים לחלוטין. עדויות עדכניות מצביעות על כך ש- mTORC1 מדכא קטוגנזה באופן שעשוי להיות במורד הזרם לאיתור האינסולין (Kucejova et al., 2016), התואם את התצפיות ש- mTORC1 מעכב אינדוקציה של Hmgcs2 של PPAR? (Sengupta et al., 2010) ( ראה גם תקנה של HMGCS2 ו- SCOT / OXCT1).

תצפיות ראשוניות מקבוצתנו מצביעות על השלכות כבדות שליליות של אי ספיקה קטוגנית (Cotter et al., 2014). כדי לבדוק את ההשערה לפגיעה בקטוגנזה, אפילו במצבים מלאים בפחמימות ובכך במצבים "לא קטוגניים", תורמת לחילוף החומרים הלא תקין של גלוקוז ומעוררת סטטו-הפטיטיס, יצרנו מודל עכבר של אי ספיקה קטוגנית ניכרת על ידי מתן אוליגו-גרעינים נוגדי חושים (ASO) הממוקדים Hmgcs2. אובדן HMGCS2 בעכברים בוגרים סטנדרטיים דלי שומן הניזונים משומן גרמה להיפרגליקמיה קלה והגדילה באופן ניכר את הייצור של מאות מטבוליטים בכבד, שחבילה שלהם הציעה בחום הפעלת ליפוגנזה. האכלה בתזונה עתירת שומן של עכברים עם קטוגנזה לא מספק הובילה לפגיעה נרחבת בכבד ולדלקת. ממצאים אלה תומכים בהשערות המרכזיות לפיהן (i) קטוגנזה איננה מסלול הצפה פסיבי אלא צומת דינמית בהומאוסטזיס פיזיולוגי בכבד ומשולב, וכן (ii) הגדלה קטוגנית נבונה להפחתת NAFLD / NASH ומטבוליזם של גלוקוז בכבד מופרע ראוי לבדיקה. .
כיצד עלול לקטוגנזה לקויה לתרום לפגיעה בכבד ולשינוי הומאוסטזיס של הגלוקוז? השיקול הראשון הוא האם האשם הוא מחסור בשטף קטוגני, או קטונים עצמם. דו"ח שנערך לאחרונה מציע כי גופי קטון עשויים למתן פגיעה בכבד הנגרמת מלחץ חמצוני כתגובה לחומצות שומן רב בלתי רוויות n-3 (Pawlak et al., 2015). כזכור, בגלל חוסר ביטוי של SCOT בהפטוציטים, גופי הקטון אינם מחומצנים, אך הם יכולים לתרום לליפוגנזה, ולשרת מגוון תפקידי איתות ללא תלות בחמצון שלהם (ראה גם גורלות מטבוליים שאינם מחמצנים של גופי קטון ו-? OHB כ מגשר איתות). יתכן גם שגופי קטון שמקורם בהפטוציטים עשויים לשמש אות ו / או מטבוליט לסוגי תאים שכנים בתוך האצינוס הכבד, כולל תאי כוכבים ומקרופאגים של תאי Kupffer. למרות שהספרות המוגבלת הקיימת מעידה על כך שמקרופאגים אינם מסוגלים לחמצן גופי קטון, הדבר נמדד רק באמצעות מתודולוגיות קלאסיות, ורק במקרופאגים פריטונאליים (Newsholme et al., 1986; Newsholme et al., 1987), דבר המצביע על כך ש- ההערכה מתאימה בהתחשב בביטוי SCOT בשפע במקרופאגים שמקורם במח העצם (Youm et al., 2015).
השטף הקטוגני של הפטוציטים עשוי גם להיות מגן על ציטוטים. בעוד שמנגנוני ההכרה עשויים שלא להיות תלויים בקטוגנזה כשלעצמה, דיאטות קטוגניות דלות בפחמימות נקשרו לשיפור ב- NAFLD (Browning et al., 2011; Foster et al., 2010; Kani et al., 2014; Schugar and Crawford, 2012) . התצפיות שלנו מצביעות על כך שקטוגנזה של הפטוציטים עשויה להעביר משוב ולווסת את שטף מחזור ה- TCA, את השטף האפלרוטי, את הגלוקונאוגנזה הנגזרת מפוספונולפירובט (Cotter et al., 2014) ואפילו מחזור גליקוגן. ליקוי קטוגני מכוון את אצטיל-CoA להגביר את שטף ה- TCA, אשר בכבד נקשר לפגיעה מוגברת בתיווך ROS (Satapati et al., 2015; Satapati et al., 2012); מכריח הסטת פחמן למיני שומנים מסונתזים דה נובו שעלולים להוכיח ציטוטוקסיות; ומונע חמצון מחדש של NADH ל- NAD + (Cotter et al., 2014) (איור 4). יחדיו, נדרשים ניסויים עתידיים לטיפול במנגנונים שבאמצעותם אי ספיקה קטוגנית יחסית עלולה להיות בלתי-מסתגלת, לתרום להיפרגליקמיה, לעורר סטטו-הפטיטיס והאם מנגנונים אלה פעילים ב- NAFLD / NASH האנושי. כראיות אפידמיולוגיות מצביעות על פגיעה בקטוגנזה במהלך התקדמות דלקת המוח (Embade et al., 2016; Marinou et al., 2011; M nnist et al., 2015; Pramfalk et al., 2015; Safaei et al., 2016) טיפולים המגבירים קטוגנזה בכבד יכולים להוכיח את ההשלכה (Degirolamo et al., 2016; Honda et al., 2016).
גופי Ketone וכישלון לב (HF)
עם קצב חילוף חומרים העולה על 400 קק"ל / ק"ג ליום ומחזור של 6 ק"ג ATP ליום, הלב הוא האיבר בעל ההוצאה האנרגטית הגבוהה ביותר והביקוש לחמצון (Ashrafian et al., 35; Wang et al., 2007 ב). הרוב המכריע של מחזור האנרגיה בשריר הלב נמצא בתוך המיטוכונדריה, ו -2010% מההיצע הזה מקורו ב- FAO. הלב הכלכלי וגמיש בתנאים רגילים, אך הלב המחדש פתולוגי (למשל עקב יתר לחץ דם או אוטם שריר הלב) והלב הסוכרת הופכים כל אחד לגמיש מטבולית (Balasse and Fery, 70; BING, 1989; Fukao et al., 1954 ; Lopaschuk et al., 2004; Taegtmeyer et al., 2010; Taegtmeyer et al., 1980; Young et al., 2002). ואכן, חריגות מתוכנתות גנטית של מטבוליזם של דלק לב במודלים של עכברים מעוררות קרדיומיופתיה (Carley et al., 2002; Neubauer, 2014). בתנאים פיזיולוגיים לבבות נורמליים מחמצנים גופי קטון ביחס למסירתם, על חשבון חמצון חומצות שומן וגלוקוז, ושריר הלב הוא הצרכן הגבוה ביותר בגוף הקטון ליחידת מסת (BING, 2007; Crawford et al., 1954; GARLAND et al. ., 2009; Hasselbaink et al., 1962; Jeffrey et al., 2003; Pelletier et al., 1995; Tardif et al., 2007; Yan et al., 2001). בהשוואה לחמצון חומצות שומן, גופי קטון יעילים יותר מבחינה אנרגטית, ומניבים יותר אנרגיה זמינה לסינתזת ATP לכל מולקולה של חמצן שהושקע (יחס P / O) (Kashiwaya et al., 2009; Sato et al., 2010; Veech, 1995) . חמצון גוף קטון גם מניב אנרגיה גבוהה יותר מ- FAO, תוך שמירה על חמצון של אוביקווינון, מה שמגדיל את טווח החמצון בשרשרת הובלת האלקטרונים והופך יותר אנרגיה לזמינה לסינתזה של ATP (Sato et al., 2004; Veech, 1995). חמצון של גופי קטון עשוי גם לצמצם את ייצור ה- ROS, ובכך מתח חמצוני (Veech, 2004).
מחקרים ראשוניים התערבות התצפית מצביעים על תפקיד פוטנציאלי של גופים קטון בלב. בהקשר של ניסוי איסכמיה / reperfusion ניסיוני, גופי ketone העניקו השפעות קרדיופרטיביות אפשריות (Al-Zaid et al., 2007, Wang et al., 2008), אולי בשל העלייה בשכיחות המיטוכונדריאלית בלב או בויסות של זרחון חמצוני חיוני מתווכים (Snorek et al., 2012; Zou et al., 2002). מחקרים אחרונים מצביעים על כך שהשימוש בגופני קטון גדל בלבבות עכברים כושלים (Aubert et al, 2016) ובני אדם (Bedi et al, 2016), התומכים בתצפיות מוקדמות בבני אדם (BING, 1954, Fukao et al, 2000; ג'נרדאן ואח ', 2011, לונגו ואח', 2004, רודולף ושנץ, 1973, Tildon ו- Cornblath, 1972). ריכוז גדילי קטון מוגבר אצל חולי אי ספיקת לב, ביחס ישיר ללחצי מילוי, תצפיות שמנגנוןן וחשיבותן אינן ידועות (Kupari et al, 1995, Lommi et al., 1996, Lommi et al., 1997; Neely et al , 1972), אבל עכברים עם חסר SCOT סלקטיבית cardiomyocytes התערוכה שיפוץ מואץ חדריית פתולוגית וחתימות ROS בתגובה פגיעה בלחץ יתר המושרה לחץ כירורגי (Schugar et al., 2014).
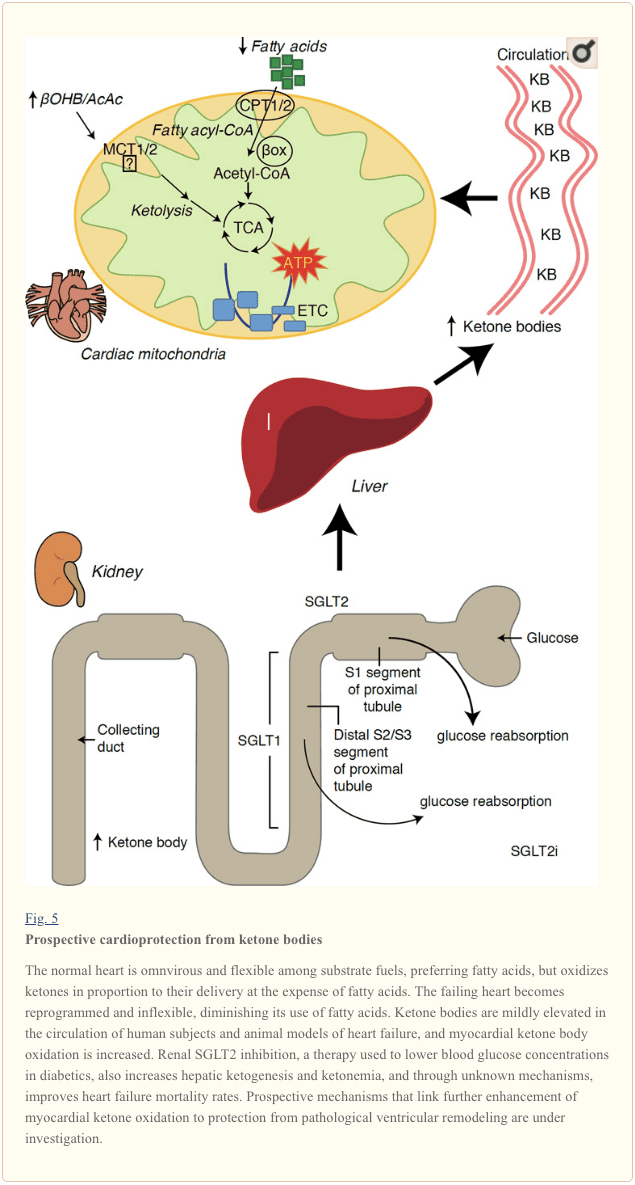
תצפיות מסקרנות האחרונות בטיפול בסוכרת חשפו קשר פוטנציאלי בין חילוף החומרים של קטון בשריר הלב לבין שיפוץ חדרי הלב הפתולוגי (איור 5). עיכוב של נתרן צינורי פרוקסימלי / גלוקוז שיתוף טרנספורטר 2 (SGLT2i) מגדילה את ריכוזי הגוף קטון בבני אדם (Ferrannini et al, 2016a, Inagaki et al., 2015) ועכברים (סוזוקי ואח ', 2014) דרך גדל (Frannini et al, 2014, Ferrannini et al, 2016a, כץ ולייטר, 2015, Mudaliar et al, 2015). באופן מפתיע, לפחות אחד מהסוכנים הללו הפחית את אשפוז ה- HF (למשל, כפי שהתגלה על-ידי מחקר ה- EMPA-REG OUTCOME) ותמותה קרדיווסקולארית משופרת (Fitchett et al, 2016, Sonesson et al., 2016; Wu et al., 2016a , זינמן ואחרים, 2015). בעוד שמנגנוני הנהיגה שמאחורי תוצאות ה- HF המועילות ל- SGLT2i מקושרים באופן פעיל, יתרון ההישרדות עשוי להיות רב-תכליתי, כולל פרוקטקטיבי, כולל השפעות משלימות על משקל, לחץ דם, רמות גלוקוז ורמת חומצת השתן, קשיחות עורקים, מערכת העצבים הסימפתטית, אוסמוטי dioresis / נפח פלזמה מופחת, והגדילה hematocrit (רז ו Cahn, 2016, Vallon ו Thomson, 2016). יחד עם זאת, הרעיון כי הגדלת קטונמיה טיפולית בחולי HF, או אלו הנמצאים בסיכון גבוה לפתח HF, נשאר שנוי במחלוקת, אך הוא נמצא תחת חקירה פעילה במחקרים קליניים ופרה-קליניים (Ferrannini et al., 2016b, Kolwicz et al. 2016, Lopaschuk ו Verma, 2016, Mudaliar ואח ', 2016, Taegtmeyer, 2016).
גופי קטון בביולוגיה של הסרטן
הקשר בין גופי קטון לסרטן מתפתח במהירות, אך מחקרים במודלים של בעלי חיים ובני אדם הניבו מסקנות שונות. מכיוון שמטבוליזם של קטון הוא תגובה דינמית ומזינתית, הוא מפתה לעקוב אחר קשרים ביולוגיים לסרטן בשל הפוטנציאל של טיפולים תזונתיים מדויקים. תאי סרטן עוברים תכנות מחדש מטבולי על מנת לשמור על התפשטות תאים מהירה וצמיחה (DeNicola ו- Cantley, 2015, Pavlova ו- Thompson, 2016). האפקט הקלאסי של ורבורג בחילוף החומרים בתאי הסרטן נובע מהתפקיד הגומי של הגליקוליזה ותסיסת חומצת החלב כדי להעביר אנרגיה ולפצות על תלות נמוכה יותר בזירחון חמצוני ובנשימה מיטוכונדריאלית מוגבלת (De Feyter et al., 2016; Grabacka et al., 2016; Kang et al., 2015, Poff et al., 2014, Shukla et al., 2014). גלוקוז הפחמן מופנה בעיקר באמצעות גליקוליזה, נתיב פוספט pentose, ו lipogenesis, אשר יחד לספק intermediates הדרושים להרחבת ביומסה הגידול (Grabacka ואח ', 2016, Shukla et, 2014, Yoshii ואח', 2015). ההסתגלות של תאים סרטניים למניעת גלוקוז מתרחשת באמצעות היכולת לנצל מקורות דלק חלופיים, כולל אצטט, גלוטמין ואספרט (Jaworski et al., 2016; Sullivan et al., 2015). לדוגמה, הגישה המוגבלת לפירובט מגלה את היכולת של תאים סרטניים להמיר גלוטמין לתוך אצטיל- COA על ידי carboxylation, שמירה על צרכים אנרגטיים אנאבוליים (יאנג ואח ', 2014). הסתגלות מעניינת של תאים סרטניים היא ניצול של אצטט כדלק (Comerford et al., 2014, Jaworski et al., 2016; Mashimo et al., 2014; רייט וסימון, 2016, Yoshii ואח ', 2015). אצטט הוא גם מצע לליפוגנזה, שהוא קריטי עבור התפשטות תאי הגידול, והרווח של צינור ליפוגני זה קשור להישרדות מטופלים קצרה יותר ולנטל גידול גדול יותר (Comerford et al., 2014; Mashimo et al., 2014; Yoshii et al ., 2015).
תאים שאינם סרטניים מעבירים בקלות את מקור האנרגיה שלהם מגלוקוז לגופי קטון במהלך מחסור בגלוקוז. פלסטיות זו עשויה להיות משתנה יותר בקרב סוגי תאים סרטניים, אך גידולי מוח מושתלים in vivo התחמצנו [2,4-13C2] -? OHB במידה דומה לרקמת המוח המקיפה (De Feyter et al., 2016). מודלים של "אפקט ורבורג הפוך" או "שני מטבוליזם של גידולים בתאים" משערים כי תאים סרטניים גורמים לייצור OHB בפיברובלסטים סמוכים, המספקים את צורכי האנרגיה של תא הגידול (Bonuccelli et al., 2010; Martinez-Outschoorn et al., 2012). . בכבד, מעבר בהפטוציטים מקטוגנזה לחמצון קטון בתאי קרצינומה hepatocellular (hepatoma) תואם להפעלה של פעילויות BDH1 ו- SCOT שנצפו בשתי שורות תאי hepatoma (Zhang et al., 1989). ואכן, תאי הפטומה מבטאים OXCT1 ו- BDH1 ומחמצנים קטונים, אך רק כאשר סרום מורעב (Huang et al., 2016). לחלופין, הוצע גם קטוגנזה של תאי גידול. שינויים דינמיים בביטוי גנים קטוגניים מוצגים במהלך טרנספורמציה סרטנית של אפיתל המעי הגס, סוג תאים המבטא בדרך כלל את HMGCS2, ודוח שנערך לאחרונה העלה כי HMGCS2 עשוי להיות סמן פרוגנוסטי של פרוגנוזה גרועה בקרצינומות של תאי המעי הגס והקשקש (Camarero et al., 2006; חן ואח ', 2016). האם קשר זה מחייב או כרוך בקטוגנזה, או פונקציה של אור הירח של HMGCS2, נותר לקבוע. לעומת זאת, לכאורה ייצור OHB על ידי מלנומה ותאי גליובלסטומה, מגורה על ידי ה- PPAR? אגוניסט fenofibrate, היה קשור למעצר גדילה (Grabacka et al., 2016). מחקרים נוספים נדרשים כדי לאפיין תפקידים של ביטוי HMGCS2 / SCOT, קטוגנזה וחמצון קטון בתאים סרטניים.
מעבר לתחום חילוף החומרים בדלק, קטונים היו מעורבים לאחרונה בביולוגיה של תאים סרטניים באמצעות מנגנון איתות. ניתוח של מלנומה BRAF-V600E + הצביע על אינדוקציה תלויה ב- OCT1 של HMGCL באופן תלוי ב- BRAF אונקוגני (Kang et al., 2015). הגדלת HMGCL הייתה בקורלציה עם ריכוז AcAc תאי גבוה יותר, אשר בתורו שיפר את האינטראקציה של BRAFV600E-MEK1, והגביר את איתות MEK-ERK בלולאה הזנה המניעה התפשטות וצמיחה של תאי הגידול. תצפיות אלה מעלות את השאלה המסקרנת של קטוגנזה חוץ-כבדת פוטנציאל התומכת אז במנגנון איתות (ראה גם? OHB כמתווך איתות ומחלוקות בקטוגנזה חוץ-כבדית). חשוב גם לבחון את ההשפעות העצמאיות של AcAc, d-? OHB ו- l-? OHB על חילוף החומרים בסרטן, וכאשר שוקלים HMGCL, גם קטבוליזם של לאוצין עלול להיפגע.
ההשפעות של דיאטות קטוגניות (ראה גם שימוש טיפולי בתזונה קטוגנית ובגופי קטון אקסוגניים) במודלים של בעלי חיים בסרטן מגוונות (De Feyter et al., 2016; Klement et al., 2016; Meidenbauer et al., 2015; Poff et al. ., 2014; Seyfried et al., 2011; Shukla et al., 2014). בעוד שנחשבים קשרים אפידמיולוגיים בין השמנת יתר, סרטן ודיאטות קטוגניות (Liskiewicz et al., 2016; Wright and Simone, 2016), מטא-אנליזה באמצעות דיאטות קטוגניות במודלים של בעלי חיים ובמחקרים בבני אדם הציעה השפעה מכריעה על ההישרדות, עם יתרונות הקשורים באופן פרוספקטיבי לגודל הקטוזיס, זמן התחלת הדיאטה ומיקום הגידול (Klement et al., 2016; Woolf et al., 2016). טיפול בתאי סרטן הלבלב עם גופי קטון (d-? OHB או AcAc) עיכב צמיחה, התפשטות וגליקוליזה, ודיאטה קטוגנית (81% קק"ל שומן, 18% חלבון, 1% פחמימה) הפחיתה משקל גידול in vivo, גליקמיה, ו הגדלת שריר ומשקל הגוף בבעלי חיים עם סרטן מושתל (Shukla et al., 2014). תוצאות דומות נצפו באמצעות מודל תאי גליובלסטומה גרורתי בעכברים שקיבלו תוסף קטון בתזונה (Poff et al., 2014). לעומת זאת, דיאטה קטוגנית (91% שומן קק"ל, 9% חלבון) הגדילה את ריכוז ה- OHB במחזור הדם והפחיתה את הגליקמיה, אך לא הייתה השפעה על נפח הגידול או על משך ההישרדות בחולדות נושאות גליומה (De Feyter et al., 2016). אינדקס קטון לגלוקוז הוצע כמדד קליני המשפר את הטיפול המטבולי בטיפול בסרטן המוח הנגרם על ידי דיאטה קטוגנית בבני אדם ובעכברים (Meidenbauer et al., 2015). יחדיו, התפקידים של חילוף החומרים בגוף הקטון וגופי הקטון בביולוגיה של סרטן מרתקים מכיוון שלכל אחד מהם אפשרויות טיפוליות ניתנות לניתוח, אך נותר להבהיר היבטים בסיסיים, עם השפעות ברורות העולות ממטריצה של משתנים, כולל (i) הבדלים בין קטון אקסוגני. גופים לעומת תזונה קטוגנית, (ii) סוג תאים סרטניים, פולימורפיזם גנומי, דרגה ושלב; (iii) תזמון ומשך החשיפה למצב הקטוטי.

Ketogenesis נוצר על ידי גופים קטון דרך התמוטטות של חומצות שומן וחומצות אמינו ketogenic. תהליך ביוכימי זה מספק אנרגיה לאיברים שונים, במיוחד למוח, בנסיבות של צום כתגובה לאי זמינות של גלוקוז בדם. גופי Ketone מיוצרים בעיקר במיטוכונדריה של תאי הכבד. בעוד תאים אחרים מסוגלים לבצע ketogenesis, הם לא יעילים כמו בתאי הכבד. מכיוון שקטוגנזה מתרחשת במיטוכונדריה, התהליכים שלה מוסדרים באופן עצמאי. ד"ר אלכס Jimenez DC, תובנה CCST
יישום טיפולי של דיאטה קטוגנית וגופי קטון אקסוגניים
היישומים של דיאטות קטוגניות וגופי קטון ככלי טיפולי התעוררו גם בהקשרים לא סרטניים כולל השמנת יתר ו- NAFLD / NASH (Browning et al., 2011; Foster et al., 2010; Schugar and Crawford, 2012); אי ספיקת לב (Huynh, 2016; Kolwicz et al., 2016; Taegtmeyer, 2016); מחלה נוירולוגית וניוונית (Martin et al., 2016; McNally and Hartman, 2012; Rho, 2015; Rogawski et al., 2016; Yang and Cheng, 2010; Yao et al., 2011); טעויות מולדות של מטבוליזם (Scholl-Bourggi et al, 2015); וביצועי פעילות גופנית (Cox et al., 2016). היעילות של דיאטות קטוגניות הוערכה במיוחד בטיפול בהתקפים אפילפטיים, במיוחד בקרב חולים עמידים לתרופות. מרבית המחקרים העריכו דיאטות קטוגניות בחולי ילדים, וחשפו ירידה של עד ~ 50% בתדירות ההתקפים לאחר 3 חודשים, עם יעילות משופרת בתסמונות נבחרות (Wu et al., 2016b). הניסיון מוגבל יותר באפילפסיה של מבוגרים, אך ניכרת ירידה דומה, עם תגובה טובה יותר בחולי אפילפסיה כללית סימפטומטית (Nei et al., 2014). המנגנונים האנטי פרכסיים הבסיסיים נותרים לא ברורים, אם כי השערות מבוססות כוללות שימוש מופחת / גליקוליזה של גלוקוזה, הובלת גלוטמט מתוכנת מחדש, השפעה עקיפה על תעלת אשלגן רגישה ל- ATP או על קולטן אדנוזין A1, שינוי ביטוי איזופורמי של ערוץ הנתרן, או השפעות על הורמונים במחזור כולל לפטין ( Lambrechts et al., 2016; Lin et al., 2017; Lutas and Yellen, 2013). עדיין לא ברור אם ההשפעה האנטי פרכוסית מיוחסת בעיקר לגופי קטון, או בגלל ההשלכות המטבוליות המפלות של דיאטות דלות בפחמימות. עם זאת, נראה כי אסטרים של קטונים (ראה להלן) מעלים את סף ההתקפים במודלים של בעלי חיים של התקפים מעוררים (Ciarlone et al., 2016; D'Agostino et al., 2013; Viggiano et al., 2015).
דיאטות פחמימות נמוכות וקטוגניות, לעיתים קרובות נחשבות לא נעימות, ועשויות לגרום לעצירות, היפר-ריאקמיה, היפוקלוקמיה, היפומגנסמיה, להוביל לנפרוליטיאזיס, לקטואסידוזיס, לגרום היפרגליקמיה, ולהעלות את כולסטרול הדם ואת ריכוז חומצות השומן החופשי (Bisschop et al., 2001 קוסוב והרטמן, 2012, Kwiterovich ואחרים, 2003, סוזוקי ואח ', 2002). מסיבות אלה, דבקות ארוכת טווח מציבה אתגרים. מחקרים מכרסמים בדרך כלל משתמשים בהפצה ייחודית של מקרונוטריינטים (94% שומן קק"ל, 1% פחמימות פחמימות, 5% חלבון קק"ל, Bio-Serv F3666), מה שמעורר קטוזיס חזק. עם זאת, הגדלת תכולת החלבון, אפילו ל- 10% קק"ל מפחית באופן משמעותי את ketosis, ו 5% הגבלת חלבון קקאל מעניק מבלבל השפעות מטבוליות ופיזיולוגיות. ניסוח דיאטה זה הוא גם מדולדל כולין, משתנה נוסף המשפיע על רגישות לפגיעה בכבד, ואפילו קטוגנזה (Garbow et al, 2011, Jornayvaz ואח ', 2010, קנדי ואח', 2007, פיסיוס ואח ', 2013; Schugar et al., 2013). ההשפעות של צריכה ארוכת טווח של דיאטות ketogenic בעכברים להישאר מוגדרים חלקית, אך מחקרים שנעשו לאחרונה עכברים חשף הישרדות נורמלי היעדר של סמני פגיעה בכבד בעכברים על דיאטות ketogenic על תוחלת החיים שלהם, למרות מטבוליזם חומצות אמינו, הוצאות אנרגיה, ואת האינסולין איתות (Douris et al., 2015).
מנגנונים הגדלים קטוזיס באמצעות מנגנונים חלופיים דיאטות ketogenic כוללים את השימוש מבשרי בגוף קטון. מינון של גופי קטון אקסוגניים יכול ליצור מצב פיזיולוגי ייחודי לא נתקל בפיזיולוגיה נורמלי, כי מחזורי גלוקוז וריכוזי אינסולין הם נורמליים יחסית, בעוד תאים עשויים לחסוך ספיגה וניצול גלוקוז. לגופי הקטון עצמם מחצית חיים קצרים, ובליעה או עירוי של נתרן? מלח OHB להשגת קטוזיס טיפולי מעורר עומס נתרן לא רע. R / S-1,3-butanediol הוא דיאלכוהול לא רעיל שמתחמצן בקלות בכבד כדי להניב d / l-? OHB (Desrochers et al., 1992). בהקשרים ניסיוניים מובהקים, מנה זו ניתנה מדי יום לעכברים או לחולדות במשך שבעה שבועות, והניבה ריכוזי OHB במחזור של עד 5 מ"מ בתוך שעתיים מהניהול, שהיא יציבה לפחות 2 שעות נוספות (D ' אגוסטינו ואח ', 3). דיכוי חלקי של צריכת מזון נצפתה מכרסמים נתון R / S-1,3-butanediol (נגר וגרוסמן, 1983). בנוסף, שלושה אסטרי קטונים מובחנים כימית (KE), (i) מונואסטר של R-1,3-בוטנידיול ו- d-? OHB (R-3-hydroxybutyl R-? OHB); (ii) גליצריל-טריס- OHB; ו- (iii) R, S-1,3-butanediol acetoacetate diester, נחקרו בהרחבה (Brunengraber, 1997; Clarke et al., 2012a; Clarke et al., 2012b; Desrochers et al., 1995a; Desrochers et al. ., 1995b; Kashiwaya et al., 2010). יתרון מובנה של הקודם הוא ש -2 שומות של d-? OHB מיוצרות למול KE, בעקבות הידרוליזה של אסטראז במעי או בכבד. בטיחות, פרמקוקינטיקה וסובלנות נחקרו באופן נרחב ביותר בבני אדם שנטלו R-3-hydroxybutyl R-? OHB, במינונים של עד 714 מ"ג / ק"ג, והניבו ריכוזי d-? OHB במחזור של עד 6 מ"מ (Clarke et al., 2012a; Cox et al., 2016; Kemper et al., 2015; Shivva et al., 2016). במכרסמים, KE זה מקטין את צריכת הקלוריות ואת הכולסטרול הכולל של הפלזמה, מגרה רקמת שומן חומה ומשפר את עמידות האינסולין (Kashiwaya et al., 2010, Kemper et al., 2015, Veech, 2013). ממצאים אחרונים מצביעים על כך שבמהלך פעילות גופנית אצל ספורטאים מאומנים, בליעת R-3-hydroxybutyl R-? OHB הפחיתה את גליקוליזת שרירי השלד ואת ריכוזי הלקטט בפלזמה, הגדילה את חמצון הטריאציל-גליצרול תוך שריר ושמרה על תכולת הגליקוגן בשרירים, גם כאשר הפחמימה שנבלעה יחד גירתה הפרשת אינסולין ( קוקס ואח ', 2016). פיתוח נוסף של תוצאות מסקרנות אלה נדרש, שכן השיפור בביצועי פעילות הסיבולת הונע בעיקר על ידי תגובה חזקה ל- KE במקצועות 2 / 8. יחד עם זאת, תוצאות אלו תומכות במחקרים קלאסיים המצביעים על העדפת תחמוצת קטון על פני מצעים אחרים (GARLAND et al, 1962, Hasslbaink ואח ', 2003, סטנלי ואח', 2003, Valente-Silva ואח ', 2015) כולל במהלך פעילות גופנית, וכי ספורטאים מאומנים עשויים להיות מיומנים יותר לשימוש בקטונים (ג'ונסון ואחרים, 1969a, ג'ונסון ווולטון, 1972, Winder et al, 1974, Winder et al, 1975). לבסוף, המנגנונים שעשויים לתמוך בביצועים מימוש משופרים בעקבות צריכת קלוריות שווה (מופץ באופן דיפרנציאלי בין מקרו-חומרי) ושיעורי צריכת חמצן שווים יישארו.
מבט לעתיד
לאחר שסטיגמה ברובם כנתיב הצפה המסוגל לצבור פליטות רעילות בעירת שומן במצבים מוגבלים של פחמימות (הפרדיגמה ה"קטוטוקסית "), התצפיות האחרונות תומכות ברעיון שחילוף החומרים בגוף הקטון משרת תפקידים מקדמים גם במצבים עמוסי פחמימות, ופותח" קטוהורמטית ". השערה. הגישות התזונתיות והפרמקולוגיות הקלות על מניפולציה של חילוף החומרים של הקטונים הופכות אותו למטרה טיפולית אטרקטיבית, אך במעבדות המחקר הבסיסיות ובתרגום נותרו ניסויים אגרסיביים אך זהירים. צרכים שלא סיפקו הופיעו בתחומי הגדרת התפקיד של מינוף חילוף החומרים של הקטון באי ספיקת לב, השמנת יתר, NAFLD / NASH, סוכרת מסוג 2 וסרטן. ההיקף וההשפעה של תפקידי איתות 'לא קנוניים' של גופי קטון, כולל ויסות כספומטים העשויים להאכיל ולהתקדם למסלולי חילוף החומרים והסימנים, מחייבים בדיקה מעמיקה יותר. לבסוף, קטוגנזה מחוץ לכבד יכולה לפתוח מנגנוני איתות פראקריניים ואוטוקריניים מסקרנים והזדמנויות להשפיע על חילוף חומרים משותף במערכת העצבים ובגידולים להשגת מטרות טיפוליות.
תודות
Ncbi.nlm.nih.gov/pmc/articles/PMC5313038/
הערות שוליים
לסיכום, גופי קטון נוצרים על ידי הכבד על מנת לשמש כמקור אנרגיה כאשר אין מספיק גלוקוז זמין בגוף האדם. קטוגנזה מתרחשת כאשר יש רמות גלוקוז נמוכות בדם, במיוחד לאחר שמוצו מאגרי פחמימות תאיים אחרים. מטרת המאמר לעיל הייתה לדון בתפקידים הרב ממדיים של גופי קטון בחילוף החומרים בדלק, איתות וטיפול. היקף המידע שלנו מוגבל לבעיות בריאות כירופרקטיקה ובעמוד השדרה. כדי לדון בנושא, אל תהסס לשאול את ד"ר חימנז או ליצור איתנו קשר ב 915-850-0900 .
אושר על ידי ד"ר אלכס Jimenez
הפניה ל:Ncbi.nlm.nih.gov/pmc/articles/PMC5313038/

דיון בנושא נוסף: "כאבי גב חריפים
כאב גבזהו אחד הגורמים השכיחים ביותר לנכות וימי החמצה בעבודה ברחבי העולם. כאבי גב מייחסים את הסיבה השנייה בשכיחותה לביקורים במשרדי רופאים, שנמצאים במספרם רק בזיהומים בדרכי הנשימה העליונות. כ- 80 אחוז מהאוכלוסייה יחוו כאבי גב לפחות פעם אחת במהלך חייהם. עמוד השדרה הוא מבנה מורכב המורכב מעצמות, מפרקים, רצועות ושרירים, בין רקמות רכות אחרות. פציעות ו / או תנאים מחמירים, כגון דיסקים, יכול בסופו של דבר להוביל לסימפטומים של כאבי גב. פציעות ספורט או פגיעות בתאונות דרכים הן לעיתים קרובות הגורם השכיח ביותר לכאבי גב, אולם לפעמים התנועות הפשוטות ביותר יכולות לגרום לתוצאות כואבות. למרבה המזל, אפשרויות טיפול אלטרנטיביות, כמו טיפול כירופרקטי, יכולות לעזור להקל על כאבי גב באמצעות התאמות בעמוד השדרה ומניפולציות ידניות, ובסופו של דבר לשפר את הקלה בכאב.

EXTRA EXTRA | חשוב נושא: מומלץ אל Paso, TX Chiropractor
***
המידע כאן בנושא "תפקידים רב-ממדיים של גופי קטון" אינו מיועד להחליף מערכת יחסים אחד על אחד עם איש מקצוע מוסמך בתחום הבריאות או רופא מורשה ואינו ייעוץ רפואי. אנו ממליצים לך לקבל החלטות בתחום הבריאות על סמך המחקר והשותפות שלך עם איש מקצוע מוסמך.
היקף המידע שלנו מוגבל לכירופרקטיקה, שרירים ושלד, תרופות פיזיות, בריאות, אטיולוגי תורם הפרעות ויסרוסומטיות במצגות קליניות, דינמיקה קלינית של רפלקס סומטויסצרלי, תסביכי תת-לוקסציה, בעיות בריאותיות רגישות ו/או מאמרים, נושאים ודיונים ברפואה תפקודית.
אנו מספקים ומציגים שיתוף פעולה קליני עם מומחים מדיסציפלינות שונות. כל מומחה נשלט על ידי היקף העיסוק המקצועי שלו וסמכות הרישיון שלו. אנו משתמשים בפרוטוקולים פונקציונליים של בריאות ובריאות כדי לטפל ולתמוך בטיפול בפציעות או הפרעות של מערכת השרירים והשלד.
הסרטונים, הפוסטים, הנושאים, הנושאים והתובנות שלנו מכסים עניינים קליניים, נושאים ונושאים הקשורים ותומכים במישרין או בעקיפין בהיקף העיסוק הקליני שלנו.*
משרדנו ניסה באופן סביר לספק ציטוטים תומכים וזיהה את המחקר או המחקרים הרלוונטיים התומכים בפוסטים שלנו. אנו מספקים עותקים של מחקרי מחקר תומכים הזמינים למועצות הרגולטוריות ולציבור על פי בקשה.
אנו מבינים כי אנו מכסים עניינים הדורשים הסבר נוסף כיצד זה עשוי לסייע בתכנית טיפול מסוימת או בפרוטוקול טיפולי; לכן, כדי לדון בהמשך בנושא לעיל, אנא אל תהסס לשאול ד"ר אלכס חימנז, די.סי, או צור איתנו קשר בכתובת 915-850-0900.
אנחנו כאן כדי לעזור לך ולמשפחתך.
ברכות
ד"ר אלכס חימנז זֶרֶם יָשָׁר, MSACP, RN*, CCST, IFMCP*, CIFM*, ATN*
דוא"ל: coach@elpasofunctionalmedicine.com
מורשה כדוקטור לכירופרקטיקה (DC) ב טקסס & ניו מקסיקו*
מס' רישיון טקסס DC TX5807, ניו מקסיקו DC # רישיון NM-DC2182
מורשה כאחות מוסמכת (RN*) in פלורידה
פלורידה רישיון RN רישיון # RN9617241 (מס' שליטה 3558029)
סטטוס קומפקטי: רישיון רב מדינות: מורשה להתאמן ב 40 מדינות*
ד"ר אלכס חימנז DC, MSACP, RN* CIFM*, IFMCP*, ATN*, CCST
כרטיס הביקור הדיגיטלי שלי