Neuroinflammation:
תַקצִיר
קווים מרובים של ראיות תומכים בתפקיד הפתוגני של דלקת נוירו-דלקתית במחלה פסיכיאטרית. בעוד שמחלות אוטואימוניות סיסטמיות הן סיבות מתועדות היטב להפרעות נוירופסיכיאטריות, אנספליטידים אוטואימוניות סינפטיים עם תסמינים פסיכוטיים לעיתים קרובות מוכרות פחות. במקביל לקשר בין סימפטומים פסיכיאטריים לבין אוטואימוניות במחלות אוטואימוניות, מתרחשות הפרעות נוירו-אימונולוגיות בהפרעות פסיכיאטריות קלאסיות (לדוגמה, דיכאון, דו-קוטבי, סכיזופרניה והפרעות אובססיביות-קומפולסיביות). חקירות לתוך פתופיזיולוגיה של תנאים אלה הדגיש באופן מסורתי dysregulation של מערכות glutamatergic ו monoaminergic, אבל המנגנונים האלה הפרעות נוירוטרנסמיטר נשאר חמקמק. אנו בודקים את הקשר בין אוטואימוניות לבין הפרעות נוירופסיכיאטריות, ואת הראיות האנושיות והניסוייות התומכות בתפקיד הפתוגני של נוירו-דלאמטציה בהפרעות פסיכיאטריות נבחרות. ההבנה כיצד אינטראקציות פסיכו-סוציאליות, גנטיות, אימונולוגיות ומערכות נוירוטרנסמיטר יכולות לחשוף רמזים פתוגניים ולעזור למקד טיפולים מונעים ותסמינים חדשים.
מילות מפתח:
- Neuroinflammation,
- Psychoneuroimmunology,
- אסטרוציטים,
- Microglia,
- ציטוקינים,
- מתח חמצוני,
- דִכָּאוֹן,
- הפרעה אובססיבית-כפייתית,
- הפרעה דו קוטבית, סכיזופרניה
תוכן
מבוא
ככל שזיהויים ביולוגיים מזוהים יותר ויותר בקרב חולים עם הפרעות פסיכיאטריות, ההבחנה בין מחלה נוירולוגית לפסיכיאטרית נמוגה. בנוסף למחלות אוטואימוניות מערכתיות הקשורות לתופעות פסיכיאטריות (לדוגמה, זאבת), לאחרונה, חולים עם פסיכוזה מבודדת חריפה זוהו עם אנצפליטידים אוטואימוניות סינפטיים (טבלה 1) [1-2]. מטופלים אלו מאובחנים בטעות עם הפרעות פסיכוטיות ראשוניות עקשניות, דבר המעכב את תחילת הטיפול החיסוני היעיל (טבלה 6). בנוסף, ראיות גוברות תומכות בתפקיד הפתוגני של נוגדנים נוגדי-נוירונים בהפרעות נוירו-פסיכיאטריות [1].
הפרדה בין הפרעות נוירולוגיות ופסיכיאטריות, הנתמכת על ידי תפיסת הנפש של דקארט כישות מובחנת מבחינה אונטולוגית ועל ידי יכולת השחזור של הפרעות נוירופתולוגיות, שלטה ברפואה ב�את 19th ומאות 20th מוקדם [8]. מאז, אוסף מתרחב של גורמים ביולוגיים לשחזור, מ neurosyphilis, ראש טראומה, שבץ, גידול, demyelination ועוד רבים אחרים גרמו תסביכים סימפטום כי חפיפה עם הפרעות פסיכיאטריות קלאסי [9-11]. לאחרונה, תועדו חריגות נוירו-דלקתיות ואימונולוגיות בחולים עם הפרעות פסיכיאטריות קלאסיות.
מאפננים חיסוניים היקפיים יכולים לגרום לתסמינים פסיכיאטריים במודלים של בעלי חיים ובבני אדם [12-19]. חיות בריאות שהוזרקו עם IL-1 פרו-דלקתי? וציטוקינים של גורם נמק גידול אלפא (TNF-?) מדגימים "התנהגות חולית" הקשורה לנסיגה חברתית [12]. בבני אדם, זריקות של אנדוטוקסין במינון נמוך משביתות את הסטריאטום הגחון, אזור קריטי לעיבוד תגמול, ומייצרות אנהדוניה סימפטום דיכאוני מתיש [14]. כ-45% מחולי הפטיטיס C שאינם מדוכאים וחולי סרטן שטופלו ב-IFN-? מפתחים תסמיני דיכאון הקשורים לעלייה ברמות IL-6 בסרום [12,15,17,18].
מצבים רפואיים הקשורים להפרעות דלקתיות ואימונולוגיות כרוניות, כולל השמנת יתר, סוכרת, מחלות ממאירות, דלקת מפרקים שגרונית וטרשת נפוצה, מהווים גורמי סיכון לדיכאון והפרעה דו-קוטבית [10,12,13,15,17,18]. החיובי�מתאם בין מצבים רפואיים אלה לבין מחלה פסיכיאטרית מצביע על נוכחות של תהליך דלקתי נפוץ נפוץ המשפיע על המוח בין איברים אחרים [10,19,20]. מחקר המבוסס על אוכלוסייה שנתית של 30 הראה כי בעל מחלה אוטואימונית או אשפוז מוקדם עבור זיהום חמור הגדילה את הסיכון לפתח סכיזופרניה על ידי 29% ו 60%, בהתאמה [16]. יתר על כן, וירוס הרפס סימפלקס, Toxoplasma gondii, cytomegalovirus, וכן שפעת במהלך ההריון להגדיל את הסיכון לפתח סכיזופרניה [16].
הפרעות אימונולוגיות היקפיות [21,22] (טבלה 2) והומורליות [13,21-23] שכיחות יותר בחולים פסיכיאטריים בהשוואה לביקורות בריאות. הן במחקרי פיילוט (n = 34 חולים עם הפרעת דיכאון מג'ורי (MDD), n = 43 ביקורות בריאים) והן מחקרי שכפול (n = 36 MDD, n = 43 מטופלים בריאים), בדיקת נסיוב הכוללת תשעה סמנים ביולוגיים בסרום הבדיל בין נבדקי MDD לבין בריאים בקרות עם רגישות של 91.7% וספציפיות של 81.3%; סמנים ביולוגיים מוגברים באופן משמעותי לתסמינים נוירו-פסיכיאטריים היו המולקולות האימונולוגיות אלפא 1 אנטיטריפסין, מיאלופרוקסידאז ו-TNF-? קולטן II [23].
 ראשית, אנו בודקים את הקשר בין אוטואימוניות לבין הפרעות נוירופסיכיאטריות, כולל: 1) זאבת מערכתית erythematosus (SLE) כאב טיפוס של מערכת חיסונית מערכתית; 2) אנצפליטידים אוטואימוניים הקשורים בסרום אנטי-סינפטי וגלוטוקסי חומצה דקרבוזילאז (GAD) נוגדנים עצמיים; ו - 3) הפרעות אוטואימוניות נוירופסיכיאטריות ילדים הקשורות לזיהומים סטרפטוקוקליים (PANDAS) ודיסציפלייה אובססיבית-כפייתית (OCD) הקשורה עם נוגדנים עצמיים נוגדי גלקסיות / תאלאמיים. לאחר מכן אנו דנים בתפקיד של דלקת / אוטואימוניות מולדת בהפרעות פסיכיאטריות קלאסיות, כולל MDD, הפרעה דו קוטבית (BPD), סכיזופרניה ו- OCD.
ראשית, אנו בודקים את הקשר בין אוטואימוניות לבין הפרעות נוירופסיכיאטריות, כולל: 1) זאבת מערכתית erythematosus (SLE) כאב טיפוס של מערכת חיסונית מערכתית; 2) אנצפליטידים אוטואימוניים הקשורים בסרום אנטי-סינפטי וגלוטוקסי חומצה דקרבוזילאז (GAD) נוגדנים עצמיים; ו - 3) הפרעות אוטואימוניות נוירופסיכיאטריות ילדים הקשורות לזיהומים סטרפטוקוקליים (PANDAS) ודיסציפלייה אובססיבית-כפייתית (OCD) הקשורה עם נוגדנים עצמיים נוגדי גלקסיות / תאלאמיים. לאחר מכן אנו דנים בתפקיד של דלקת / אוטואימוניות מולדת בהפרעות פסיכיאטריות קלאסיות, כולל MDD, הפרעה דו קוטבית (BPD), סכיזופרניה ו- OCD.
הפרעות נוירופסיכיאטריות המשויכות לאוטואימוניות
זאבת מערכתית אריתמטוס
בין 25% ל-75% מחולי SLE יש מעורבות של מערכת העצבים המרכזית (CNS), כאשר תסמינים פסיכיאטריים מתרחשים בדרך כלל בשנתיים הראשונות להופעת המחלה. תסמינים פסיכיאטריים עשויים לכלול חרדה, מצב רוח והפרעות פסיכוטיות [97]. הדמיית תהודה מגנטית מוחית (MRI) תקינה בכ-42% ממקרי ה-SLE הנוירו-פסיכיאטריים [97]. מיקרואנגיופתיה והתמוטטות מחסום המוח בדם (BBB) עשויים לאפשר כניסה של נוגדנים עצמיים למוח [97]. נוגדנים אלה כוללים P אנטי-ריבוזומלי (חיובי ב-90% מחולי SLE פסיכוטיים) [1], תא אנטי-אנדותל, אנטי-גנגליוסיד, אנטי-dsDNA, יחידות משנה אנטי-2A/2B של קולטני N-methyl-D-aspartate ( NMDAR) ונוגדנים אנטי-פוספוליפידים [97]. ציטוקינים פרו דלקתיים בעיקר IL-6 [97], S100B�[97], מולקולת הידבקות תוך-תאית 1 [97] ומטריקס- מטאלופרוטאינאז-9 [98] מוגברת גם ב-SLE. ביטויים פסיכיאטריים של SLE, מחלת Sjo?gren, תסמונת Susac, CNS vasculitis, CNS Whipple ומחלת Behc?et נסקרו לאחרונה [1].
אנצפליטידים נוירו-פסיכיאטרים הקשורים לסרום אנטי-סינפטי וחומצה גלוטמית דקארבוקסילאז
נוגדנים עצמיים
אנצפליטידים אוטואימוניים מאופיינים בהתפרצות חריפה של התקפי האונה הטמפורלית, מאפיינים פסיכיאטריים וחסרים קוגניטיביים [2,3,99-108]. הפתופיזיולוגיה מתווכת בדרך כלל על ידי נוגדנים עצמיים המכוונים אוטואנטיגנים סינפטיים או תוך תאיים בשיתוף עם מקור פרנאו פלסטי או לא פראנאופסטי [3]. נוגדנים עצמיים אנטי-סינפטיים מכוונים לתת-יחידות NR1 של NMDAR [100,108,109], קומפלקסים של תעלות אשלגן תלויות-מתח (VGKC) (תת-יחידת Kv1, גליומה עשירה בליוצין מושבתת (LGI1) וחלבון הקשור ל-Contactin 2 (CASPR2) [101,102,106], GluR, 1 תת-יחידות GluR2 של קולטן חומצה אמינו-3-הידרוקסי-5-מתיל-l-4-איזוקסאזולפרופיונית (AMPAR) [6,110,111] ויחידות משנה B1 של קולטני חומצה ?-אמינובוטירית B (GABABR) [3,99,103]. נוגדנים עצמיים אנטי-תאיים מכוונים לאוטגנים אונקונירונליים ו-GAD-65 [2,3].
הדלקת המשויכת לנוגדנים עצמיים אנטי-סינפטיים, בעיקר נוגדנים עצביים נוגדי-נוגדנים, היא בדרך כלל קלה יותר מזו הקשורה ל- GAD- נוגדנים עצמיים או נוגדנים עצביים נוגדי-נוירונים הקשורים להפרעות מערכתיות או תסמונות פרנופלסטיות [2,107].
למרות שהתסמינים נוירולוגים מופיעים בסופו של דבר, תופעות פסיכיאטריות, החל מחרדה [2,3] לפסיכוזה מחקה סכיזופרניה [2-6], יכולות בתחילה לשלוט או להקדים תכונות נוירולוגיות. עד שני שלישים מהחולים עם דלקת ריאות אוטואימונית נוגדת NMDAR, נוכחים בתחילה לשירותים פסיכיאטריים [5]. נוגדנים אנטי-סינפטיים מתווכי אוטואימוניות מתווכת חייבים להיחשב בהפרש של פסיכוזה חריפה [2-6]. מצגות פסיכיאטריות יכולות לכלול MRI מוחי רגיל ומניעת נוזל מוחי (CSF), ללא אנצפלופתיה או התקפים [2,3,5,6,107]. דיווחנו על מקרה של נוגדנים עצביים של GAD כרוניים הקשורים לדלקת נוירו-דלקתית מוכחת בביופסיה, למרות ניתוחי MRI רגילים וניתוח CSF, שבו המטופל הציג פסיכוזה מבודדת שאובחנה כסכיזופרניה על ידי מדריך אבחוני וסטטיסטי של הפרעות נפשיות, קריטריונים של 4th Edition (DSM-IV) [2]. יתר על כן, אנצפליטידים אוטואימוניות סרנגגטיבים יכולים להופיע גם עם הפרעות נוירופסיכיאטריות בולטות, מה שהופך את האבחנה לחמקנית יותר [107,112,113]. תכונות פסיכיאטריות ונוירולוגיות הקשורות לסנטיאטיבים אנטי-סינפטיים ו- GAD מסוכמים בטבלה 1 [1-6,99-108,114].
נוגדנים עצמיים אנטי-סינפטיים ו-GAD עשויים להופיע בחולים עם הפרעות פסיכיאטריות טהורות [2,4,5,112,115-121]. בקבוצה פרוספקטיבית של 29 נבדקים שעמדו בקריטריונים של DSM-IV לסכיזופרניה, נמצאו נוגדנים עצמיים נגד NMDAR בנסיוב בשלושה נבדקים, ונוגדנים עצמיים נגד VGKC-complex נמצאו בנבדק אחד [5]. באמצעות טכניקות רגישות יותר לזיהוי נוגדנים עצמיים של אימונוגלובולין G (IgG) NR1 ב-100 חולים עם סכיזופרניה ברורה, לא זוהו נוגדנים עצמיים [122]. עם זאת, מחקר זה לא העריך נוגדנים עצמיים המכוונים לתת-היחידה NR2 של NMDAR. מחקרים אחרים דיווחו על עלייה משמעותית בסיכויים לרמות גבוהות של נוגדני NR90 (אחוזון 2 לא פסיכיאטרי) רמות נוגדני NR2.78 (יחס סיכויים (OR) 95, רווח בר סמך של 1.26% (CI) 6.14 עד 0.012, P = 43) בקרב אנשים עם מאניה חריפה ( n = 116), אך לא במאניה כרונית או סכיזופרניה [XNUMX].
PANDAS והפרעה אובססיבית-קומפולסיבית טהורה הקשורה לגרעינים אנטי-בסיסיים / נוגדנים עצמיים תלמיים
OCD מסבך לעתים קרובות הפרעות נוירולוגיות המערבות את הגרעינים הבסיסיים כולל כוריאה של Sydenham, מחלת הנטינגטון ומחלת פרקינסון. נוגדנים נגד גנגליונים אנטי-בזאליים מעורבים בכוריאה של Sydenham [123]. PANDAS מאופיינת בהחמרה חריפה של תסמיני OCD ו/או טיקים מוטוריים/פוניים בעקבות זיהום סטרפטוקוקלי פרודרומלי A ?-המוליטי. הפתופיזיולוגיה נחשבת כרוכה בתגובתיות צולבת בין נוגדנים אנטי-סטרפטוקוקליים וחלבוני גנגליונים בסיסיים [124]. החפיפה הקלינית בין PANDAS ל-OCD הטהור מציעה מנגנון אטיולוגי משותף [125].
מבין קבוצה אקראית של 21 חולי OCD טהורים, ל-91.3% היו גרעיני CSF אנטי-בזאליים (P <0.05) ונוגדנים עצמיים אנטי-תלמודיים (P <0.005) ב-43 kDa [88], מקבילות להפרעות תפקודיות ב-cortico-striatal-thalamo מעגלים קורטיקו של נבדקי OCD [84]. מחקר אחר תיעד כי ל-42% (n=21) מהנבדקים בילדים ובמתבגרים OCD היו נוגדנים עצמיים של גנגליונים אנטי-בזאליים בסרום ב-40, 45 ו-60 kDa בהשוואה ל-2% עד 10% מהביקורות (P = 0.001) [7]. נוגדנים עצמיים של גנגליונים אנטי-בזאליים זוהו בסרה של 64% מהנבדקים PANDAS (n=14), בהשוואה ל-9% בלבד (n=2) מהביקורות החיוביות לסטרפטוקוקליות/OCD-שליליות (P <0.001) [126]. מחקר אחד לא מצא הבדל בין השכיחות של נוגדנים עצמיים של גנגליונים אנטי-בזאליים ב-OCD (5.4%, n=4) לעומת בקרות MDD (0%) [127]; עם זאת, מגבלה הייתה השימוש האקראי בקליפת החולדות ובגרעיני הבסיס והקורטקס של בקר, שעלול היה להגביל את הזיהוי של מקרים סרו-חיוביים.
האנטיגנים האוטו-אנטיגנים של הגרעינים הבסיסיים הם אלדולאז C (40 kDa), אנולאז ספציפי/לא עצבי (כפולת 45 kDa) ו-pyruvate kinase M1 (60 kDa) אנזימים גליקוליטים עצביים המעורבים בהולכה עצבית, חילוף חומרים עצבי.
עמוד 3 של 24 ותא איתות [128]. אנזימים אלה מפגינים הומולוגיה מבנית משמעותית לחלבונים סטרפטוקוקליים [129]. המחקר האחרון (96 OCD, 33 MDD, 17 סכיזופרניה נבדקים) נבדק בסרום נגד סרום pyruvate קינאז, aldolase C ו enolase, במיוחד; פרופורציה גדולה יותר של נבדקי OCD הייתה חיובית ביחס לסרו (19.8% (n = 19) לעומת 4% [n = 2], P = 0.012) [130].
עם זאת, באותו מחקר רק אחד מסוגי OCD של 19 חיובי ל- OCR היה גם נוגדנים נוגדי- O נוגדנים חיוביים נגד אנטי-סטרפטוליסין, דבר המצביע על כך שב- OCD טהור סרום נוגדנים נגד סטרפטוליסין O לא מבטל את נוכחותם של נוגדנים עצמיים נגד גרגליית הבסיס .
ב- OCD טהור, סרום-פוזיטיביות של נוגדנים נוגדי גלקסיה / טאלאמיים נגד בזל קשורה לרמות גבוהות של גליצין CSF (P = 0.03) [88], דבר המצביע על כך שאנטי-גופים אלה תורמים ל- hyperglutamatergia שנצפתה ב- OCD [84,88,131]. השיפור ב- OCD המעורר זיהום עם טיפולים חיסוניים תומך בפתוגניות של נוגדנים אלו [132]. ניסוי גדול של NIH העריך את היעילות של אימונוגלובולינים תוך ורידיים (IVIG) לילדים עם נוגדנים חריגים של OCD ונוגדנים סטרפטוקוקליים (ClinicalTrials.gov: NCT01281969). עם זאת, הממצאים של רמות גלוטמט נמוכות יותר ב- CSF בחולי OCD עם גנגליש אנטי-בזאלי של גידלי ה- CSF, בהשוואה לאלו עם נוגדנים CSF חיוביים, מראים שמנגנונים לא-אימונולוגיים יכולים לשחק תפקיד ב- OCD [84]. מנגנונים אחרים, כולל דלקת בתיווך ציטוקינים (טבלה 2), משוערים גם הם.
הפרעות פסיכיאטריות המשויכות לדלקת מולדת
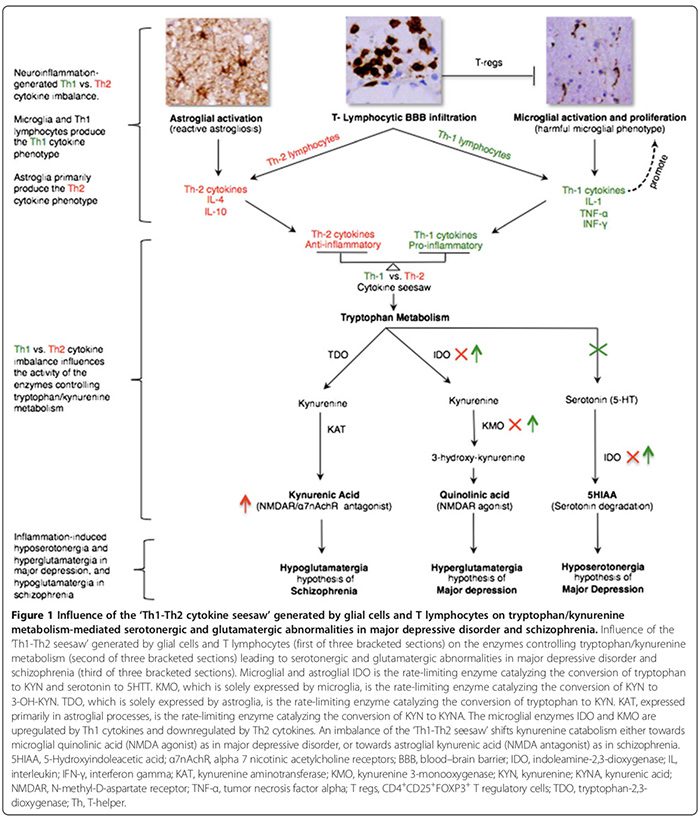
הפרעות של דלקת מולדת/אוטואימוניות מתרחשות בחלק מהחולים עם הפרעות פסיכיאטריות קלאסיות. אנו דנים במומים מולדים הקשורים לדלקת במערכת העצבים המרכזית, לרבות פתולוגיה גליאלית, רמות ציטוקינים גבוהות, הפעלת cyclo-oxygenase, חוסר ויסות של גלוטמט, עלייה ברמות S100B, עלייה בלחץ חמצוני וחוסר תפקוד BBB ב-MDD, BPD, סכיזופרניה ו-OCD. אנו גם מתארים כיצד דלקת מולדת עשויה להיות קשורה באופן מכניסטי להפרעות המונו-אמינרגיות והגלוטמטרגיות המסורתיות שדווחו בהפרעות אלו (איורים 1 ו-2). התפקיד הטיפולי של חומרים נוגדי דלקת בהפרעות פסיכיאטריות נסקר גם כן.
 היסטופתולוגיה אסטרוגליאלית ואוליגודנדרוגלית
היסטופתולוגיה אסטרוגליאלית ואוליגודנדרוגלית
אסטרוגליה ו oligodendroglia חיוניים עצביים מטבולית הומאוסטזיס, התנהגות ותפקודים קוגניטיביים גבוהים יותר [54-56,133-136]. אסטרוגליות שקטה רגילות מספקות אנרגיה ותמיכה טרופית לנוירונים, מווסתות העברה עצבית סינפטית (איור 2), סינפטוגנזה, זרימת דם מוחית ושומרות על שלמות BBB [134,136,137]. אוליגודנדרוליות בוגרות מספקות אנרגיה ותמיכה טרופית לנוירונים ושומרות על שלמות BBB, ומווסתות תיקון אקסונלי�ואת myelination של שטחי החומר הלבן המספק קישור בין-פנים ו- hemispheric [54-56]. הן אסטרוגליה ו oligodendroglia לייצר ציטוקינים אנטי דלקתיים שיכולים למטה לווסת דלקת מזיקה [52,55].
ב MDD, אובדן astrolial היא עקבית שלאחר המוות ממצא בתחומים רלוונטיים תפקודית, כולל קליפת המוח civulate הקדמי, קליפת המוח הפריפרונטאלית, האמיגדלה, וחומר לבן [35-38,42-46,55,138-147], עם כמה יוצאים מן הכלל [42,43]. מחקרים לאחר המוות הראו ירידה בצפיפות האסטרוגליאלית (GFAP) בחלבון הגבירי (GFAP) בעיקר בקליפת המוח הפריפרונטאלית [37,38] ובאמיגדלה [36]. ניתוח פרוטאומי גדול של הקורטקס הפרונטלי מחולים מדוכאים הראה ירידה משמעותית בשלושה איסופורמים של GFAP [39]. למרות שבמחקר אחד שדיווח על אי ספיקת גליאלית משמעותית, ניתוח תת-קבוצות גילה ירידה משמעותית (75%) בצפיפות האסטרוגליאה החיובית של GFAP בקרב נבדקי המחקר הצעירים מגיל 45 [35]. מחקר morphometric דומה הראה שום שינויים בצפיפות גלייה במוח MDD בסוף החיים [148]. אנו משערים כי העדר לכאורה של אובדן astroglial בקרב חולים מבוגרים MDD עשוי לשקף אסטרוגליוזיס משנית [35] המשויך לגיל מבוגר [42,50] ולא שלילי אמיתי.
מחקרים בבעלי חיים תואמים מחקרים בבני אדם המראים אובדן אסטרוגליאלי ב-MDD. חולדות Wistar-Kyoto, הידועים כמפגינות התנהגויות דמויות דיכאון, חשפו צפיפות אסטרוגליאלית מופחתת באותם אזורים כפי שנצפו בבני אדם [40]. מתן הסוכן הרעיל לאסטרוגליאלי, L-alpha-aminoadipic acid, גורם לתסמינים דמויי דיכאון בחולדות, מה שמצביע על כך שאובדן אסטרוגליאלי הוא פתוגני ב-MDD [41].
מחקרים לאחר המוות של נבדקי MDD תיעדו צפיפות oligodendroglial מופחתת בקורטקס הפריפרונטלי והאמיגדלה [54-57,66], שעשויים להיות תואמים לשינויים בחומר הלבן של MRI במוקדי המוח שצוינו מדי פעם אצל חלק מחולי MDD [57]. עם זאת, הפרעות בכלי הדם יכול גם לתרום לשינויים אלה [57].
ב BPD, כמה מחקרים להפגין הפסד גליה משמעותי [138,143,149,150], בעוד אחרים לא [37,44-46]. ממצאים לא עקביים אלה עשויים לנבוע מחוסר שליטה בטיפול ב- 1 עם מייצבי מצב הרוח, משום שלאחר הניתוח שלאחר הניתוח שדווח על ידי מחקרים מסוימים, חלה ירידה משמעותית באובדן גלייה רק לאחר שליטה בטיפול בחומר ליתיום וחומצה ואלפרואית [46]; 2) צורות משפחתיות של BPD, כמו אובדן גליה בולט במיוחד בקרב חולי BPD עם היסטוריה משפחתית חזקה [143]; ו / או, 3) המצב השולט של דיכאון לעומת מאניה, כמו אובדן גלייה הוא תכופים MDD [35-38,42-46,55,138-147]. אם astroglia או oligodendroglia חשבון עבור רוב אובדן גליה אינו ברור; בעוד ניתוח פרוטאומי הראה ירידה משמעותית באסטרוגרם GFAP אסטרוגליאלי אחד [39], מספר מחקרים נוספים לאחר המוות, שנמצאו ללא שינוי [36,37] או צמצמו את הביטוי האסטרוגליאלי החיובי של GFAP בקורטקס האורביטופרונאלי [47], או צפיפות oligodendroglial מופחתת [54- 56,58,59].
ב סכיזופרניה, הפסד astroglial הוא מציאה עקבית [48,150]. בעוד שמחקרים אחדים לא הראו שום אסטרולוגיה אסטרוגליסטית משמעותית, מספר אחרים מצאו צפיפות אסטרוגליסטית מופחתת [42,50,51] והפחתות משמעותיות בשני איסופורמים של GFAP [37,38,43,44,48,49,151]. ממצאים לא עקביים יכולים לנבוע מ: 39) תחלואה של MDD, אשר קשורה לעיתים קרובות עם אובדן גלייה; 1) וריאציה של גיל, כאשר חולים מבוגרים יותר הגדילו את האסטרוגליה החיובית של GFAP [2]; 35,42,50) אזורית [3] ו השתנות השכבה קליפת המוח [150]; 48) עם תרופות אנטי-פסיכוטיות, כפי שמחקרים ניסיוניים הראו גם צמצום [4] והגדילה את צפיפות האסטרוגליזם [152] הקשורה בטיפול אנטי-פסיכוטי כרוני [153]; ו 70) מצב המחלה (למשל, התאבדות לעומת התנהגות לא התאבדותית) [5]. מחקרים שלאחר המוות תועדו אובדן oligodendroglial [154-54,56,60], במיוחד בקליפת המוח הקדמית, קורטקס הקדמי הקדמי, והיפוקמפוס [65,148,155,156]. בדיקה אולטרא-מבנית של האזור הפריפרונטאלי הראתה סיבים חריפים במיאלין בחומר אפור ולבן; הן הגיל והן משך המחלה היו מתואמים באופן חיובי עם הפרעות בחומר הלבן [148].
בניגוד להפרעות נוירודגנרטיביות הקשורות בדרך כלל להתפשטות האסטרוגליזם [136], הפרעות פסיכיאטריות קשורות במקום זאת לצפיפות אסטרוגליסטית מופחתת או בלתי משתנה [138]. העדר צפיפות גליה מוגברת בהפרעות פסיכיאטריות מוקדמות [44,138] עשוי לשקף את קצב ההתדרדרות הניוונית במחלות פסיכיאטריות [138].
אנו מניחים ששינויים ניווניים הקשורים להפרעות פסיכיאטריות הם עדינים יותר ואינם חמורים מספיק כדי לעורר גורמי שעתוק תוך תאי אסטרוגליאליים המווסתים בצורה חיובית אסטרוגליוזיס, כולל מפעיל מתמר אותות של שעתוק 3 וגורם גרעיני kappa B (NF-?B) [136].
בעוד שרוב המחקרים שלאחר המוות התמקדו בשינוי צפיפות הדליות ב- MDD, BPD וסכיזופרניה, אחרים תיארו שינויים במורפולוגיה של תאי גלייה, עם ממצאים מעורבים. ב MDD ו BPD, גודל גליה הוא גדל או ללא שינוי [55]. מחקר אחד מצא ירידה בגודל גלייה ב- BPD וסכיזופרניה, אך לא ב- MDD [43]. מחקר שלאחר המוות של מטופלים מדוכאים שהתאבדו מצא גידול בגודל האסטרוגליאל בחומר הלבן הקדמי של הסינגולה, אך לא בקורטקס [158]. מחקר אחד בחולים סכיזופרניים מצא ירידה ניכרת בגודל האסטרוגליאלי בשכבה V של הקורטקס הפריפרונטלי dorsolateral, למרות שצפיפות האסטרוגליאה כפולה מזו של פקדים באותה השכבה [48]. התוצאות המעורבות עשויות לשקף באופן חלקי מחקרים קודמים על שינויים גליאליים במחלות פסיכיאטריות שלא ציינו אסטרוגליה לעומת oligodendroglia [148].
אובדן גליה במחלות פסיכיאטריות עשוי לתרום לדלקת עצבית באמצעות מספר מנגנונים, כולל רמות ציטוקינים חריגות (ראה סעיף ציטוקינים), מטבוליזם לא מווסת של גלוטמט (ראה סעיף גלוטמט), חלבון S100B מוגבר (ראה סעיף S100B),�ושינו את תפקוד ה- BBB (ראה מחסום דם מוחי סעיף), וכתוצאה מכך לקוי קוגניציה והתנהגות [44,45,54,133,159].
Histopathology microglial
Microglia הם תאים החיסון של תושב של CNS. הם מספקים מעקב חיסוני מתמשך ווסתים גיזום סינפטי התפתחותי [160,161]. פציעה של CNS הופכת מיקרוגלייה מונעת על-ידי שימוש במיקרו-גלגלות של תאים דמויי-מוטות, המבוצעים על-גבי מוט ומופעלים על-ידי מקרופאג, אשר מתרבים ונודדים לעבר אתר הפציעה לאורך מעברי chemotactic (כלומר, הפעלה מיקרו-גליאלית והתפשטות (MAP)) [161]. תאים microglial האדם להביע NMDARs כי עשוי לתווך MAP המוביל פגיעה עצבית [162].
ב MDD, BPD וסכיזופרניה, התוצאות של מחקרים שלאחר המוות לחקור את הנוכחות של MAP מעורבים. מחקרים לאחר המוות הראו רמה מוגברת של MAP רק באחד מתוך חמישה נושאים של MDD [67]. אצל חלק מהמטופלים עם הפרעת BPD, תועדו מיקרוגליאה של אנטי-גדילה דמוית-לויקוציטים אנושיים, אשר הוצגו בתהליכים עבים, בקליפת המוח הקדמית [69]. בסכיזופרניה, בעוד שמחקרים אחדים דיווחו על רמות גבוהות של MAP ביחס לבקרות, אחרים לא הראו הבדל בין הקבוצות [22,67,70]. במחקר שלאחר המוות, בהערכת MAP ב- MDD וב- BPD; צפיפות תא מיקרוגליאלית חיובית של חומצה קינולינית הייתה מקופלת בקליפת המוח הסינגוללית הקדמית תת-קלינית וקליפת המוח הקדמית הקדמית של חולי MDD ו- BPD שהתאבדו יחסית לשליטה [53]. אנליזה פוסט-הוקטית הראתה כי MAP המוגבר יוחס אך ורק ל- MDD ולא ל- BPD, מאחר שהכתם החיסוני החיובי של המיקרוגליגל בנבדקי MDD היה גדול יותר באופן משמעותי מזה שבתת-קבוצת ה- BPD הן ב- cigulate הקדמי של תת-הזרקורים והן בקורטקס midcingulate, ומאז צפיפות המיקרוגליה הייתה דומה גם בקבוצת הביקורת וגם בקבוצת הביקורת [53]. מחקר המשווה בין כל שלושת ההפרעות (9 MDD, 5 BPD, 14 סכיזופרניה, 10 בקרים בריאים) לא הראה הבדל משמעותי בצפיפות המיקרוגליאל בין ארבע הקבוצות [68].
ניתן לייחס את התוצאות המעורבות הללו לסמנים אימונולוגיים של מיקרוגליאלים שונים הנמצאים בשימוש במחקרים שונים [70] ו / או בכישלון לשלוט בחומרת המחלה [22,53,68]. יש לציין, שלושה מחקרים לאחר המוות של MDD ו סכיזופרני נושאים תיעוד מתאם חיובי חזק בין MAP ו אובדניות בקורטקס cingulate הקדמי ו התלמודיזם mediodorsal, תלוי של אבחון פסיכיאטרי [22,53,68]. לכן, MAP עשוי להיות מדינה ולא סימן תכונה עבור MDD וסכיזופרניה.
ב- OCD, מודלים של בעלי חיים מראים שתפקוד לקוי וצמצום של פנוטיפים מסוימים של מיקרוגליאל, כגון אלה המבטאים את הגן Hoxb8, המקודד את גורם ההעתקה של ה- homeobox, עלול לגרום להתנהגות OCD דמוית [71,72].
Hoxb8 נוקאאוט עכברים התערוכה מופרזת התנהגות grooming וחרדה בשיתוף עם צפיפות microglial מופחת [71,72]. התנהגות מטורפת זו מזכירה את המאפיינים ההתנהגותיים של OCD האנושי. הזרקת Hoxb8 בעכברים נוקאאוט מבוגר Hoxb8 מבטל הפסד microglial ומשחזר התנהגות רגילה [71,72]. תפקידם של אלה פנוטיפים microglial ספציפיים OCD האדם אינו ברור.
נתונים ניסיוניים מציעים כי MAP כולל פנוטיפים מזיקים ונוירופרוטטיביים (איור 2). Microglia מזיקים אינם מבטאים histocompatibility מורכבות II II (MHC-II), ולכן, לא יכול לפעול כמו תאים מציגים אנטיגן (APC) [163,164]; [17,69,165] באמצעות סינטוקין proinflammatory, סינתזה תחמוצת החנקן סינתזה [17,166], קידום glial ו- BBB-pericyte / cyclooxygenase האנדותל, 2 (COX-2) הביטוי [167], המוביל הפרשת S100B astroglial (ראה סעיף S100B) , ו שחרור microglial גלוטמט [17,136,168,169]. Microglia מזיק גם להפריש prostaglandin E-2 (PGE-2) המקדם ייצור ציטוקינים proinflammatory, אשר בתורו מגביר את רמות PGE-2 במחזור ההזנה [29]. יתר על כן, PGE-2 מגרה ביטוי COX-2, אשר מתווכת המרה של חומצה arachidonic ל PGE-2, הגדרת מחזור הזנה נוספת [29].
Microglia neuroprotective על ידי בניגוד יכול: 1) להביע MHC-II ב vivo ו במבחנה [163,166] ולפעול כמו APC קוגני (איור 2) [163,164,166]; 2) מקלה על הריפוי ומגבילה את הפגיעה העצבית על ידי קידום הפרשת ציטוקינים נוגדי דלקת [17], גורם נוירוטרופי שמקורו במוח [17] וגורם צמיחה דמוי אינסולין - 1 [166]; ו 3) אקספרציה של חומצה אמינית טרנספורטר 2 (EAAT2) כי מבטל עודף גלוטמט תאיים [163,166], ומקדמת autoimmunity לימפוציטים עצביים T (איור 2) [163,164]. עם זאת, מחקרים נוספים נדרשים כדי לאשר את התפקיד התורם של microglia נוירוטרוטיב להפרעות נוירופסיכיאטריות בבני אדם.
במבחנה מחקרים בבעלי חיים מצביעים על כך שהיחס בין מיקרוגליות מזיקות לעומת מיקרוגליות עצביות יכול להיות מושפע מההשפעה נטו של מנגנונים נגד ויסות דלקתיים [15,74,164,166]. מנגנונים אלה כוללים את מספר תאי הוויסות CD4+CD25+FOXP3+ T ((T regs) איור 1) [15,74,164,166] ורמות הציטוקינים במוח, בעלי הגנה עצבית; IFN נמוך-? רמות עשויות לקדם מיקרוגליה עצבית (איור 2) [166], בעוד שרמות גבוהות יכולות לקדם את הפנוטיפ המזיק [166].
תפקיד הציטוקינים
ציטוקינים פרו-דלקתיים כוללים IL-1?, IL-2, IL-6, TNF-? ו-IFN-?. הם מופרשים בעיקר על ידי מיקרוגליה, לימפוציטים Th1 ומונוציטים/מקרופאגים של פנוטיפ M1 (איור 1) [15,170]. הם מקדמים דלקת מזיקה. ציטוקינים אנטי דלקתיים כוללים IL-4, IL-5 ו-IL-10. הם מופרשים בעיקר על ידי אסטרוגליה,�לימפוציטים Th2, T regs ו M2 מונוציטים פנוטיפ / מקרופאגים [15,52,74]. הם יכולים להגביל דלקת מזיקה [15,74] על ידי המרת proinflammatory M1-pheno- סוג לתוך מועיל antiinflammative M2- פנוטיפ [15], ועל ידי פוטנציאל לקדם את פנוטיפ microglial neurorotective [15,17,74,163,166]. תפקידם של ציטוקינים פרו-דלקתיים / אנטי-דלקתיים במחלות פסיכיאטריות נתמך על ידי מספר שורות של ראיות (איור 1, טבלה 2) [15,17,29,52,74].
ב-MDD, המטה-אנליזה העדכנית ביותר (29 מחקרים, 822 MDD, 726 בקרות בריאות) של ציטוקינים פרו-דלקתיים בסרום אישרה שקולטן IL-2 מסיס, IL-6 ו-TNF-? רמות מוגברות ב-MDD (סמני תכונה) [91], בעוד ש- IL-1?, IL-2, IL-4, IL-8 ו-IL-10, אינם שונים סטטיסטית מבקרים [91]. במחקר ציטוקינים ראשוני שהשווה בין תת-קבוצות MDD (47 MDD אובדניים, 17 MDD לא אובדניים, 16 בקרות בריאות), הן סרה IL-6 והן TNF-? היו גבוהות יותר באופן מובהק, בעוד שרמות IL-2 היו נמוכות משמעותית בנבדקי MDD שהתאבדו ביחס לשתי הקבוצות האחרות [96]. ממצא זה מצביע על כך ש-IL-6 ו-TNF-? הם גם סמני מצב של MDD [96]. הירידה ברמות IL-2 בסרום הקשורה להתנהגות אובדנית חריפה עשויה לשקף קשר מוגבר לקולטן המווסת שלו במוח; במקביל למטה-אנליזה שהוזכרה לעיל המראה עלייה בקולטן מסיס IL-2 ב-MDD [91]. מחקרים שחקרו את המשמעות הקלינית של ציטוקינים ב-MDD הראו כי רמות הציטוקינים בסרום מוגברות במהלך אפיזודות דיכאון חריפות [171,172] ומנורמלות בעקבות טיפול מוצלח, אך לא כושל, בתרופות נוגדות דיכאון [17] וטיפול בעוויתות חשמל [29]; ממצאים אלה מצביעים על תפקיד פתוגני אפשרי עבור ציטוקינים.
ב-BPD, שינויים בציטוקינים בסרום סוכמו בסקירה עדכנית; TNF-?, IL-6 ו-IL-8 מוגברים במהלך שלבי מאניה ודיכאוניים, ואילו IL-2, IL-4 ו-IL-6 מוגברים במהלך מאניה [92]. מחקרים אחרים הראו שסרה IL-1? ורמות הקולטן ל-IL-1 אינן שונות סטטיסטית מבקרים בריאים [92], למרות שמחקרי רקמות תיעדו רמות מוגברות של IL-1? וקולטן IL-1 בקורטקס הפרונטלי של BPD [69].
בסכיזופרניה, תוצאות ממחקרים שחקרו הפרעות בציטוקינים סותרות (טבלה 2). בעוד שמחקרים מסוימים מצאו גם ירידה בסרום פרו-דלקתית (IL-2, IFN-?) וגם מוגבר של ציטוקינים נוגדי דלקת בסרום ו-CSF (IL-10) [52], אחרים מצאו ציטוקינים פרו- ואנטי-דלקתיים מוגברים בסרום, עם דומיננטיות פרו-דלקתית [22,173,174 ]. מטה-אנליזה אחת של ציטוקינים (62 מחקרים, 2,298 סכיזופרניה, 858 בקרות בריאות) הראתה רמות מוגברות של אנטגוניסט IL-1R, sIL-2R ו-IL-6 [174]. עם זאת, מחקר זה לא הביא בחשבון את השימוש בתרופות אנטי פסיכוטיות, אשר נחשבות כמשפרות את ייצור ציטוקינים פרו-דלקתיים [52]. מטה-אנליזה עדכנית יותר של ציטוקינים (40 מחקרים, 2,572 חולי סכיזופרניה,�4,401 ביקורת) שהתייחסו לתרופות אנטי פסיכוטיות, מצאו ש-TNF-?, IFN-?, IL-12 ו-sIL-2R מוגברים באופן עקבי בסכיזופרניה כרונית ללא תלות בפעילות המחלה (סמני תכונה), בעוד ש-IL-1?, IL-6 ו גורם גדילה משתנה בטא מתאם חיובי עם פעילות המחלה (סמני מצב) [173]. תרביות תאים של תאי דם חד-גרעיניים (PBMC) שהתקבלו מחולים סכיזופרנים יצרו רמות גבוהות יותר של IL-8 ו-IL-1? באופן ספונטני וגם לאחר גירוי על ידי LPS, מה שמצביע על תפקיד עבור מונוציטים/מקרופאגים מופעלים בפתולוגיה של סכיזופרניה [175].
ב-OCD, תוצאות מסקר אקראי של ציטוקינים בסרה ו-CSF, ומחקרי PBMC בגירוי LPS, אינן עקביות [93-95,176-179]. קיים מתאם בין OCD לפולימורפיזם תפקודי באזור הפרומוטור של ה-TNF-? גן [34], למרות שמחקרים בעלי עוצמה נמוכה לא אישרו קשר זה [180]. לכן, התוצאות המעורבות ממחקרים שתיעדו עלייה או ירידה של TNF-? רמות הציטוקינים [93,176-178] עשויות לשקף את הכללתן המשתנה של תת-קבוצת נבדקי ה-OCD עם פולימורפיזם מסוים זה בקבוצות שלהם.
קיטוב תגובת ציטוקינים בדיכאון וסכיזופרניה
פנוטיפים של תגובה ציטוקינים מסווגים כ-Th1 פרו-דלקתי (IL-2, IFN-?) או Th2 אנטי-דלקתי (IL-4, IL-5, IL-10) בהתאם לתפקודים החיסוניים שהם מווסתים. בעוד ציטוקינים Th1 מווסתים חסינות מתווכת תאים המכוונת נגד אנטיגנים תוך-תאיים, ציטוקינים Th2 מווסתים חסינות הומורלית המכוונת נגד אנטיגנים חוץ-תאיים [29,52]. ציטוקינים Th1 מיוצרים על ידי לימפוציטים Th1 ומונוציטים M1 ואילו ציטוקינים Th2 מיוצרים על ידי לימפוציטים Th2 ומונוציטים M2 [29,52]. במוח, מיקרוגליה מפרישה בעיקר ציטוקינים Th1, ואילו אסטרוגליה מפרישה בעיקר ציטוקינים Th2 [29,52]. היחס ההדדי של ציטוקינים Th1:Th2, מכאן ואילך �Th1-Th2 נדנדה,� מושפע מהיחס של מיקרוגליה פעילה (עודף Th1) לאסטרוגליה (עודף Th2) ומהמשחק הגומלין בין תאי T פעילים ורמות גבוהות של גלוטמט ב-CNS. להעדיף תגובת Th1 (איור 2) [29,163,166].
חוסר האיזון של Th1-Th2 יכול להשפיע על חילוף החומרים הטריפטו-פאני על ידי שינוי האנזימים שלו [21,52] ובכך להזיז את הקטבוליזם של טריפטופן לכיוון קינורנין (KYN) וקטבוליזם של KYN אל אחד משני המטבוליטים שלה במורד הזרם; חומצה קינולינית של מיקרוגליה, שהיא תולעת תגובה של TH1 או חומצה kynnaenic אסטרוגליאלית (KYNA) (איור 1) שהיא תיווך תגובה של TH2 [21,29,170].
אנזימים לחילוף החומרים של טריפטופן המושפעים מנדנדת Th1-Th2 כוללים (איור 1): אינדולאמין 2,3-דיאוקסיגנאז (IDO) המובע על ידי מיקרוגליה ואסטרוגליה, האנזימים המגבילים את הקצב המתווכים את ההמרה של טריפטופן ל-KYN וסרוטונין ל-5- חומצה הידרוקסי-אינדולאצטית�[21,29]. Kynurenine 3-monooxygenase (KMO), המובע אך ורק על ידי מיקרוגליה, הוא האנזים המגביל את הקצב הממיר KYN ל-3-hydroxykynurenine (3-OH-KYN), אשר עובר חילוף חומרים נוסף לחומצה קינולינית [21,29]. טריפטופן-2,3-דיאוקסיגנאז (TDO), המתבטא רק על ידי אסטרוגליה, הוא האנזים המגביל את הקצב הממיר�טריפטופן ל - KYN [21,29]. Kynurenine aminotransferase (KAT), המתבטא בעיקר בתהליכים אסטרוגליאליים, הוא האנזים המגביל את קצב המתווך את ההמרה של KYN ל- KYNA [21,29].
ציטוקינים Th1 מפעילים IDO ו-KMO מיקרוגליאליים, ומעבירים את הקטבוליזם המיקרוגליאלי של KYN לכיוון קינוליני�חומצה (NMDAR אגוניסט) סינתזה, בעוד ציטוקינים Th2 in- להפעיל IDO microglial ו KMO, העברת catabol astollial KYN לכיוון TDO ו- KAT בתיווך KYNA (NMDAR אנטגוניסט) סינתזה (איור 1) [21,29].
אימונוטיפים דומיננטיים של Th1 ו-Th2 הוצעו עבור MDD וסכיזופרניה, בהתאמה, בהתבסס על דפוסי ציטוקינים היקפיים ולא של מערכת העצבים המרכזית [52,173]. אנו מאמינים שדפוסי ציטוקינים היקפיים הם סמנים פונדקאיים לא אמינים של אלה שנמצאים במערכת העצבים המרכזית. ואכן, רמות ציטוקינים היקפיות יכולות להיות מושפעות ממשתנים חוץ-CNS רבים, אשר אינם נשלטים באופן עקבי בחלק ממחקרי הציטוקינים ההיקפיים, כולל: 1) גיל, מדד מסת הגוף, תרופות פסיכוטרופיות, עישון, מתח ותנודות יממה; 2) ההשפעה של �פעילות/מצב מחלה על ייצור סינתזת ציטוקינים נבחרים [95,173]; ו-3) ההשפעות של חומרים פסיכוטרופיים על ייצור ציטוקינים [52]. זמן מחצית החיים הקצר והתחלופה המהירה של ציטוקינים בסרום [181] (לדוגמה, 18 דקות עבור TNF-? [182] לעומת 60 דקות עבור IL-10 [183]), עשויים להגביל עוד יותר את מהימנות הפרשנות שלהם רמות שנמדדו מדגימת סרה אקראית.
ב-MDD, ישנה הסכמה שתגובת אימונופנוטיפ פרו-דלקתית של Th1 שולטת (טבלה 2) [17,29]. רמות גבוהות של חומצה כינולינית במוחות MDD שלאחר המוות [53], מרמזות על נוכחות של תגובת Th1 מוגברת (איור 1) [21,29]. חומצה quinolinic CNS מוגברת יכולה לקדם אפופטוזיס בתיווך בריחת סידן של אסטרוגליה אנושית [184], אשר באופן היפותטי עשוי להקהות את�Astrolia- הנגזרות תגובה Th2 [29], tipping Th1 לעומת Th2 מסתמן איזון לטובת התגובה TH1 microglial. CNS hyposerotonergia [29] מוסיף תמיכה נוספת לתגובת TH1 עודפת, אשר מוצגת כדי להפחית את הסינתזה של סרוטונין CNS [185] ולהגביר את השפלתה (איור 1) [21,29].
CNS hyperglutamatergia עשוי גם לתרום בתגובה Th1 עודף במוח (איור 2). מחקר במבחנה מצביע על כך שהלימפוציטים הנוספים של T לימפוציטים מבטאים באופן קונבנציונאלי קולטן גלוטמט מטבוטרופי 5 (mGluR5) [164], שקשירתו לגלוטמט מעכבת את שחרור הלימפוציטים IL-6 לימפוציטית, ובכך מפחית אוטומטית את התפשטות תאי ה- Re-Active T-Effector [164]. לימפוציטים מסוג T, אך לא לימפוציטים מסוג T, יכולים לחצות את ה- BBB [37].
נתונים ניסויים מצביעים על כך שהאינטראקציה בין קולטני תאי T של לימפוציטים מסוג T משופעלים לבין התאים המציגים אנטיגן נלווים שלהם יכולה להפחית את הוויסות של mGluR5 ולעורר ביטויי mGluR1 [164]. במודלים של בעלי חיים, קישור של עודף גלוטמט לקולטני mGluR1 לימפוציטים מעודד ייצור של ציטוקינים Th1, כולל IFN-? [164].
אנו משערים שבחלק מחולי MDD, במקביל לנתונים ניסיוניים [164], הקישור של עודף גלוטמט במערכת העצבים המרכזית לקולטני ה-mGluR1 הלימפוציטיים המושרים עשויה לתרום לתגובת Th1 עודפת, כולל IFN-? (איור 2). אנו משערים ש-IFN-? בכמות קטנה, בדומה להשפעות המבחנה שלו על מיקרוגליה [166], עשויה לגרום לביטוי מיקרוגליאלי של MHC-II ו-EAAT2 [163,166], מה שמאפשר למיקרוגליה לשמש כתאים המציגים אנטיגן נלווים ולספק פונקציית ספיגה חוזרת של גלוטמט [163,164,166], בכך הופכים מיקרוגליות מזיקות לפנוטיפ נוירו-פרוטקטיבי [163,166] המשתתפים בחיסול עודף גלוטמט חוץ-תאי [163,164,166]. לכן, אנו גם משערים שתגובת Th1 עודפת בתת-קבוצות של חולי MDD היא חרב פיפיות, מקדמת דלקת מזיקה ומשמשת כמנגנון נגד ויסות מועיל שעשוי להגביל עודף נוירואקסיטוטוקסיות הקשורה לגלוטמט (איור 2).
בסכיזופרניה, בעוד שחלק מחקרי ציטוקינים היקפיים מצביעים על הדומיננטיות של אימונוטיפ/תגובה אימונוטיפ אנטי דלקתי של Th2 [52], אחרים מפריכים זאת [173,174]. עם זאת, אנו מסכימים עם המחברים שהניחו שתגובת Th2 היא הפנוטיפ הדומיננטי בסכיזופרניה [52]. רמות מוגברות במוח, CSF וסרום של KYNA [21,52] מרמזות על ירידה בוויסות של IDO ו-KMO של מיקרו-גליה, שהיא פונקציה של תגובת Th2 שמסיטה קטבוליזם KYN אסטרוגליאלי לכיוון סינתזה של KYNA (איור 1) [21,52]. פעילות KMO מופחתת וביטוי mRNA של KMO במוחות סכיזופרניים שלאחר המוות [73] עולה בקנה אחד עם עודף תגובה Th2 (איור 1). שכיחות מוגברת של הפרעות בחסינות הומורלית בתיווך Th2 בתת-קבוצות של חולי סכיזופרניה, כפי שהוכחה על ידי ספירה מוגברת של תאי B [21,76], עלייה�ייצור של נוגדנים עצמיים כולל נוגדנים אנטי-ויראליים [76] ואימונוגלובולין מוגבר E [52] מוסיף תמיכה נוספת להשערת הדומיננטיות של תגובה Th2.
דלקת נוירו-דלקת ויסות-דיס-גלוזמט CNS
גלוטמט מתווכת בין קוגניציה והתנהגות [186]. רמות גלוטמט מסוג Syn-aptic מוסדרות על ידי גלאי גליה גבוהים ו-נוירונים עצביים, כלומר, מערכת ה- XAG האחראית להחלפה מחדש של גלוטמאט / אקסארט [137,164] ו-גלוטמט אסטרוגליאלי / גלוטמט (ccine antiporter system) אחראי על שחרור גלוטמט / ספיגה מחדש של ציסטין [164]. Astrolial EAAT1 ו EAAT2 לספק יותר מ 90% של גלוטמט מחדש ספיגה [79].
Neuroinflammation יכול לשנות את מטבוליזם גלוטמט ואת הפונקציה של המובילים שלה [15,29,187,188], המייצר קוגניטיבית, התנהגותית, ופסיכיאטרית לקויות [15,21,29,79,186,188,189]. חריגות של תפקוד EAATs / ביטוי ומטבוליזם גלוטמט ב- MDD, BPD, סכיזופרניה ו- OCD מסוכמים בטבלה 2.
ב MDD, יש עדויות hyperglutamatergia קליפת המוח (טבלה 2). רמות גלוטמט בקליפת המוח היו מתואמות באופן חיובי עם חומרת הסימפטומים הדיכאוניים, וקורס של חמישה שבועות של תרופות נוגדות דיכאון ירד בריכוז גלוטמט בסרום [85,86]. מנה אחת של קטמין, אנטגוניסט חזק של NMDAR, יכולה להפוך MDD עקשן למשך שבוע [17,21,29,85]. עודף גלוטמט רמות CNS יכול לגרום דלקת נוירוטוקסיטי בתיווך [163,164,188], כולל תגובה Th1 פרוינפלמטורית (איור 2) [164].
עדויות מוגבלות במבחנה מצביעות על כך שציטוקינים דלקתיים/פרו-דלקתיים יכולים להגביר את רמות הגלוטמט במערכת העצבים המרכזית [188] במחזור הזנה קדימה באמצעות מספר מנגנונים פוטנציאליים: 1) ציטוקינים פרו-דלקתיים יכולים לעכב [15,17,168] ולהפוך [45,137] גלוטמט אסטרוגליאלי בתיווך EAAT פונקציית ספיגה חוזרת; 2) ציטוקינים פרו-דלקתיים יכולים לשפר את סינתזת החומצה הכינולית המיקרוגליאלית [53], אשר הוכח בניסוי כמקדם שחרור גלוטמט סינפטוזומלי [15,17,29,190]; 3) עלייה ב-COX-2/PGE-2 ו-TNF-? רמות יכולות לגרום לזרימת סידן [137], אשר, בהתבסס על נתונים חוץ גופיים, עשויה להגביר את שחרור הגלוטמט האסטרוגליאלי ו-D-סרין [191]; ו-4) מיקרוגליה מופעלת יכולה לבטא עודף Xc- antiporter מערכות המתווך שחרור גלוטמט [164,192].
בסכיזופרניה, נמצאו היפוגלוטמטרגיה קליפת המוח פרה-מצחית [87,90,193,194] (טבלה 2) ופונקציונליות מופחתת של NMDAR [5]. מטה-אנליזה עדכנית של H1 תהודה מגנטית (MRS) (28 מחקרים, 647 סכיזופרניה, 608 בקרה) אישרה ירידה ברמת הגלוטמט ועלייה ברמות הגלוטמין בקליפת המוח המדיאלית הקדמית [90]. התפקיד התורם של דלקת להיפוגלוטמטרגיה לא הוכח. סינתזת KYNA מוגברת במוחות סכיזופרניה [21,52], בדרך כלל פונקציה של תגובת Th2 (איור 1), יכולה לעכב תת-יחידה NR1 של NMDAR ואלפא 7 nicotinic�קולטן לאצטילכולין (?7nAchR) [195], מה שמוביל לירידה בתפקוד NMDAR והפחתת שחרור גלוטמט בתיווך ?7nAchR [195].
ב- BPD וב- OCD, הנתונים מצביעים על כך ש- CNS hyper-glutamatergia cortical בשתי הפרעות (טבלה 2) [78,84,88,131]. התרומה של דלקת (BPD ו- OCD) ונוגדנים עצמיים (OCD) [7,77,84,88,130] לרמת גלוטמט CNS מוגברת דורשת בדיקה נוספת.
תפקידו של S100B
S100B הוא חלבון קושר סידן בנפח 10 kDa המיוצר על ידי תאי אסטרוגליה, אוליגודנדרוגליה ותאי מקלעת choroid ependymal [196]. הוא מתווך את השפעותיו על הנוירונים והגליות שמסביב באמצעות הקולטן לתוצר סופי של גליקציה מתקדמת [196]. רמות S100B חוץ-תאיות ננומולריות מספקות השפעות נוירוטרופיות מועילות, מגבילות פגיעה נוירונית הקשורה ללחץ, מעכבות TNF-? שחרור, והגברת ספיגה חוזרת של גלוטמט אסטרוגליאלית [196]. לריכוזים מיקרומולריים S100B, המיוצרים בעיקר על ידי אסטרוגליות פעילים ולימפוציטים [196,197], יש השפעות מזיקות המושמעות על ידי קולטן לתוצר סופי של גליקציה מתקדם הכוללת אפופטוזיס עצבי, ייצור של COX-2/PGE-2, IL-1? ומיני תחמוצת החנקן הניתנים לשרירה, וויסות-על של TNF- מונוציטי/מיקרוגליאלי? הפרשה [21,196,198].
סרום, במיוחד, CSF ורמות רקמות המוח S100B רמות הם אינדיקאטורים של גליה (בעיקר האסטרוגליאלי) ההפעלה [199]. ב- MDD ובפסיכוזה, רמות ה- S100B בסרום מקיימות באופן חיובי את חומרת ההתאבדות, ללא תלות באבחון פסיכיאטרי [200]. ניתוח שלאחר המוות של S100B הראה רמות נמוכות בקורטקס הפריפרונטלי dorso-sideal של MDD ו- BPD, ורמות גבוהות יותר בקורטקס הקודקוד של BPD [196].
מטא-אנליזה (193 מצב רוח, 132 פקדים בריאים) אישר את רמות הסרום הגבוהות ואת רמות CSF S100B בהפרעות במצב הרוח, במיוחד במהלך אפיזודות דכאון חריפות ומאניה [201].
בסכיזופרניה, רמות המוח, ה-CSF וה-S100B בסרום גבוהות [199,202]. מטה-אנליזה (12 מחקרים, 380 סכיזופרניה, 358 נבדקים בריאים) אישרה רמות גבוהות של S100B בסרום בסכיזופרניה [203]. במוחות שלאחר המוות של נבדקי סכיזופרניה, אסטרוגליה אימונית פעילה מסוג S100B נמצאות באזורים המעורבים בסכיזופרניה, כולל קליפת מוח קדמית, קליפת מוח קדם-מצחית דורסולטרלית, קליפת מוח אורביטופרונטלית והיפוקמפי [154]. רמות גבוהות של S100B נמצאות בקורלציה עם פסיכוזה פרנואידית [154] ושלילית [204], לקויה בקוגניציה, תגובה טיפולית לקויה ומשך מחלה [202]. פולימורפיזמים גנטיים ב-S100B [32] וקולטן לגנים מתקדמים של תוצר סופי של גליקציה בקוהורטות סכיזופרניה (טבלה 2) [32,33,205] מצביעים על כך שהחריגות הללו הן ככל הנראה ראשוניות/פתוגניות ולא משניות/ביולוגיות. אכן, הירידה ברמות S100B בסרום בעקבות טיפול בתרופות נוגדות דיכאון [201] ותרופות אנטי פסיכוטיות [196] מעידה על כך�כמה רלוונטיות קלינית של S100B לפאתופיזיולוגיה של הפרעות פסיכיאטריות.
דלקת עצבית והגברת מתח חמצוני
מתח חמצוני הוא מצב שבו עודף של חמצון מזיק או משנה מקרומולקולות ביולוגיות כגון שומנים, חלבונים ודנ"א [206-209]. זה עודף תוצאות של ייצור חמצון מוגבר, ירידה חימצון חיסול, הפגמים נוגדי חמצון פגומים, או שילוב כלשהו [206-209]. המוח הוא פגיע במיוחד ללחץ חמצוני בשל: 1) כמויות גבוהות של חומצות שומן רב בלתי רוויות peroxidizable; 2) תכולה גבוהה יחסית של מינרלים עקבות המניבים חמצון בדם ורדיקלי חמצן (לדוגמה, ברזל, נחושת); 3) ניצול גבוה של חמצן; ו 3) מוגבל נגד חמצון מנגנוני [206,207].
עודף חמצוני יכול להתרחש ב- MDD [206], BPD [206,207], סכיזופרניה [207,209] ו- OCD [206,208]. סמנים היקפיים של הפרעות חמצון כוללים מוצרים מוגברים של חמצון שומנים (לדוגמה, malondialdehyde ו- 4-hydroxy-2-nonenal), מטבוליטים של תחמוצת החנקן (NO), ירידה בחומרים נוגדי חמצון (לדוגמה, גלוטתיון) ושינויי רמות אנזימים נוגדי חמצון [206,207].
ב MDD, גדל superoxide אניון ייצור רדיקלי בקורלציה עם מוגברת חמצון בתיווך אפופטוזיס נויטרופילי [206]. רמות הסרום של אנזימים נוגדי חמצון (לדוגמה, superoxide dissutase-1) מוגבהות במהלך פרקים דיכאוניים חריפים ונורמליזציה לאחר טיפול מעכבי ספיגה חוזרת של סרוטונין (SSRI) [206]. זה מצביע על כך MDD, רמות אנטי חמצון בסרום הם סמן המדינה, אשר עשוי לשקף מנגנון פיצוי כי counteracts עלייה חדה של מתח חמצוני. [206]. ב סכיזופרניה לעומת זאת, CSF מסיס סופרוקסיד דימוטאז 1 רמות מופחתות משמעותית בחולים סכיזופרניים בתחילת המחלה יחסית לחולים סכיזופרניים כרוניים ובקרה בריאה. דבר זה מצביע על כך שרמות נמוכות של אנזים נוגדי חמצון במוח עשויות לתרום לנזק חמצוני בסכיזופרניה חריפה [210], אך יש צורך במחקרים גדולים יותר כדי לאשר את הממצא.
מספר מחקרים נוספים בניסויים ובנושאים נוספים בדקו ביתר פירוט את המנגנונים שבבסיס הפאתופיזיולוגיה של לחץ חמצוני מוגבר בהפרעות פסיכיאטריות [206-262]. במודלים של בעלי חיים של דיכאון, רמות המוח של גלוטתיון מופחתים בעוד חמצון השומנים ורמות NO גדלים [206,262].
מחקרים לאחר המוות מציגים רמות מוח נמוכות של גלוטתיון מוחלט ב- MDD, BPD [206] ונושאים סכיזופרניים [206,207]. Fibroblasts מתורבת מחולי MDD מראים לחץ חמצוני מוגבר ללא תלות ברמות גלוטתיון [262], וטוענים כנגד תפקידה העיקרי של דלדול גלוטתיון כמנגנון העיקרי של לחץ חמצוני בדיכאון.
הפעלה של מיקרוגליה עשויה להגביר את הלחץ החמצוני באמצעות ייצור ציטוקינים פרו-דלקתיים ו-NO [206-209]. ציטוקינים מעודדי דלקת ורמות NO גבוהות עלולים לקדם יצירת מיני חמצן תגובתיים (ROS), אשר בתורו מאיץ את חמצון השומנים, פוגע בפוספוליפידים של הממברנה ובקולטנים של הנוירוטרנסמיטר המונואמינים הקשורים לקרום ומדלדל נוגדי חמצון אנדוגניים. מוצרי ROS מוגברים יכולים לשפר את ההפעלה של מיקרוגליה ולהגביר ייצור פרו-דלקתי באמצעות גירוי NF-?B [208], אשר בתורו מנציח פגיעה חמצונית [208], ויוצר את הפוטנציאל ללולאת משוב חיובי פתולוגי בהפרעות פסיכיאטריות מסוימות [206-209]. למרות שדלקת עצבית יכולה להגביר את רמות הגלוטמט במוח [85,86], תפקידה של היפראקטיביות גלוטמטרגית כגורם ללחץ חמצוני נותר בלתי מבוסס [207].
תפקוד לקוי של המיטוכונדריאלי עשוי לתרום ללחץ חמצוני מוגבר ב-MDD, BPD וסכיזופרניה [206]. מחקרים שלאחר המוות בהפרעות אלו מגלים חריגות ב-DNA המיטוכונדריאלי, בהתאם לשכיחות הגבוהה של הפרעות פסיכיאטריות בהפרעות מיטוכונדריאליות ראשוניות [206]. מחקרים בבעלי חיים במבחנה מראים שציטוקינים פרו-דלקתיים, כגון TNF-?, יכולים להפחית את צפיפות המיטוכונדריה ולפגוע במטבוליזם החמצוני של המיטוכונדריה [211,212], מה שמוביל לייצור ROS מוגבר [206,213]. ממצאים ניסויים אלו עשויים לרמוז על קשרים מכניסטיים בין דלקת עצבית, תפקוד לקוי של המיטוכונדריה ולחץ חמצוני [206,213], המחייבים חקירה נוספת של מסלולים פתוגניים מצטלבים אלה בהפרעות פסיכיאטריות אנושיות.
הפגיעות של רקמות עצביות לנזק חמצוני משתנה בין הפרעות פסיכיאטריות שונות בהתבסס על המסלולים הנוירו-אטומיים, הנוירוכימיים והמולקולריים המעורבים בהפרעה הספציפית [207]. השפעות הטיפול עשויות גם להיות קריטיות, שכן ראיות ראשוניות מצביעות על כך שתרופות אנטי-פסיכוטיות, SSRI ומייצבי מצב רוח הן בעלות תכונות נוגדות חמצון [206,207,262]. התפקוד הטיפולי של נוגדי חמצון אדג'ובנטיים (לדוגמה, ויטמינים C ו- E) בהפרעות פסיכיאטריות נשאר להיות מאושש על ידי ניסויים קליניים אקראיים רבי עוצמה. N-acetylcysteine מראה את התוצאות המבטיחות ביותר עד כה, עם מספר מחקרים אקראיים מבוקרי פלצבו המפגינים את יעילותו ב- MDD, BPD וסכיזופרניה [207].
תפקוד לקוי של מחסום המוח
ה-BBB מבטיח את מעמד החיסון של המוח על ידי הגבלת כניסתם של מתווכים דלקתיים היקפיים, כולל ציטוקינים ונוגדנים שעלולים לפגוע בהולכה עצבית [214,215]. ההשערה של פירוק BBB ותפקידו בחלק מהמטופלים הפסיכיאטריים [60,214,216,217] תואמת את השכיחות המוגברת של תחלואה נלווית פסיכיאטרית במחלות הקשורות לתפקוד לקוי שלו, כולל SLE [97], שבץ [11],�אפילפסיה [218] ואנצפליטידים אוטואימוניים (טבלה 1). יחס גבוה של �CSF:יחס אלבומין בסרום� בחולים עם MDD וסכיזופרניה מצביע על עלייה בחדירות BBB [214].
במחקר אחד (63 נושאים פסיכיאטריים, 4,100 שולט), חריגות CSF המצביעים על נזק ל- BBB התגלו ב- 41% מהנבדקים הפסיכיאטריים (14 MDD ו- BPD, 14 סכיזופרניה), כולל סינתזת intrathecal של IgG, IgM ו / או IgA, מתון CSF קל (5 לתאי 8 לכל mm3) ואת הנוכחות של עד 4 IgG להקות oligoclonal [216]. מחקר פוסט-תרכיתי אחד לאחר סכיזופרניה חשף הפרעות אולטרא-סטרליות ב- BBB בקורטקס הפריפרונטלי והויזואלי, שכללו ניוון של תאים אנדותליים, תהליכים באסטרוגליסטים-רגל, ועיבוי ואי-סדירות של הלמינה הבסיסית [60]. עם זאת, במחקר זה, המחברים לא התייחסו לתרומה הפוטנציאלית של שינויים שלאחר המוות לממצאים שלהם. מחקר נוסף שחקר תעתיק של תאי אנדותל של BBB במוח סכיזופרני זיהה הבדלים משמעותיים בין גנים המשפיעים על תפקוד אימונולוגי, שלא זוהו בבקרות [217].
תפקוד אנדותל בתיווך חמצון עשוי להוות תרומה לפאתופיזיולוגיה של תפקוד ה- BBB בהפרעות פסיכיאטריות. ראיות עקיפות ממחקרים קליניים וניסויים בדיכאון [219] ובמידה פחותה יותר בסכיזופרניה [220] מצביעות על כך שחמצון מוגבר עשוי לתרום לליקוי בתפקוד האנדותל. תפקוד לקוי של האנדותל עשוי לייצג מנגנון משותף המחייב את הקשר הידוע בין דיכאון למחלות לב וכלי דם [219,221], אשר עשוי להיות קשור לרמות נמוכות של vasodilator NO [221-223]. מחקרים ניסויים מצביעים על ירידה ברמות NO האנדותל מקושרות באופן מכני לאי-הצמדה של סינתזה חנקתית אנדותלאלית (eNOS) מהגורם החיוני שלה tetrahydrobiopterin (BH4), המניע את המצע שלו מ- L- ארגנין לחמצן [224-226]. Unosplated eNOS מקדם סינתזה של ROS (לדוגמה, superoxide) ומינים חנקן תגובתיים (לדוגמה, peroxynitrite, תוצר של האינטראקציה של superoxide עם NO) [227] ולא ב- NO, וכתוצאה מכך לתפקוד האנדותל בתיווך של חמצון [ 224-226].
נתונים בבעלי חיים הראו כי SSRIs יכולים לשחזר את רמות האנדותל החסרות ללא רמות [219], דבר המצביע על כך שמנגנונים אנטי-חמצוניים עשויים לתרום להשפעות נוגדות הדיכאון שלהם. אצל בני אדם, L-methylfolate עשוי להשפיע על השפעות נוגדות דיכאון של SSRI [228], על ידי הגדלת רמות ה- BH4, שהוא Cofactor חיוני עבור eNOS re-coupling-anti-oxidation [229], כמו גם עבור קצב אנליטית של מונואמין (כלומר, סרוטונין, נורדרינפרין, דופמין) סינתזה [228].
ביחד, הן העבודה האחרונה המדגישה את התפקיד של מתח חמצוני בלתי-מקושר המושרה על ידי eNOS בפתוגנזה של מחלות כלי דם [230,231] והן�מחקרים אפידמיולוגיים המקימים דיכאון כגורם סיכון תלותי לפתולוגיות של כלי הדם, כגון שבץ ומחלות לב [219,221], מוסיפים תמיכה נוספת לרלוונטיות הקלינית של נזק חמצוני לא-מצוי באנדותל של דיכאון. למרות עדויות רבות על הפרעות ציטוקינים במחלות פסיכיאטריות אנושיות, והנתונים הניסוייים מראים כי ציטוקינים פרו-דלקתיים יכולים להפחית את הביטוי eNOS [212] ולהגביר את חדירות ה- BBB [215], ראיות אנושיות המקשרות ישירות לציטוקינים פרו-דלקתיים נוספים לתפקוד ה- eNOS ו / או ליקוי BBB נָטוּל.
הדמיה וטיפול בדלקת במחלות פסיכיאטריות
הדמיה Neuroinflammation ב - Situ
מבחינה קלינית, הדמייה הנוירו-דלקתית עשויה להיות חיונית לזיהוי תת-קבוצה של חולים פסיכיאטריים עם נוירו-דלאמציה, אשר סביר להניח שהם יגיבו בחיוב לטיפולים אימונומודולטוריים. בנוסף, הדמיה כזו עשויה לאפשר לרופאים לעקוב אחר פעילות המחלה הקשורה לנוירו-דלקתיות ולתגובתה לטיפול החיסוני בחולים פסיכיאטריים. הדמיה הדמיה במוח האנושי יש באופן מסורתי תלוי MRI או הדמיה CT של סוכנים בניגוד לווריד מופרז, המציין התפלגות מקומית של BBB. מדיום MRI משופרת גדוליניום מראה מדי פעם התפלגות כזו באזורים הלימביים הקשורים לעיבוד רגשי בחולים עם הפרעות פסיכיאטריות המיוחסות לפרנספלסטיות או לאנספליטידים אחרים [107,109,113]. למיטב ידיעתנו, עם זאת, שיפור לא נורמלי מעולם לא הוכח בכל הפרעה פסיכיאטרית קלאסית [21,214,232], למרות תפקודי [214,216] פונקציונליים ו- BBB אולטרא-מבניים [60].
אם או לא נוירונפלמציה עדין יכול להיות דמיינו in vivo בהפרעות פסיכיאטריות קלאסי נשאר ידוע. אחת הטכניקות המבטיחות היא טומוגרפיה פליטת פוזיטרונים (PET) באמצעות רדיוטרקרים, כגון C11- PK11195, אשר נקשרים לחלבון translocator, הידוע בעבר בשם קולטן benzodiazepine הפריפריה, לידי ביטוי microglia מופעל [233,234].
בשיטה זו, חולים עם סכיזופרניה הוכחו כבעלי תפקוד מיקרוגליאלי גדול יותר לאורך הקורטקס [235] ובהיפוקמפוס במהלך פסיכוזה חריפה [236]. מחקר אחד (14 סכיזופרניה, 14 שולט) לא מצא הבדל משמעותי בין מחלת DA11 [1106C] ב- DA11 לבין סכיזופרניה לעומת בקרות, אך מתאם ישיר בין [1106C] לבין מחייב DAA236 לבין חומרת הסימפטומים החיוביים ומשך המחלה בסכיזופרניה [XNUMX].
חוקרים מהמוסד שלנו השתמשו ב-C11-PK11195 PET כדי להדגים דלקת דו-היפוקמפוסית בחולה עם הפרעות בתפקוד נוירופסיכיאטרי, כולל MDD פסיכוטי, אפילפסיה ואמנזיה אנטרוגרדית, הקשורים לנוגדנים נגד GAD [237]. עם זאת, ל-PK11195 PET יש�נמוכה אות לרעש נכסים ו דורש cyclotron באתר.
לפיכך, המחקר מוקדש לפיתוח משופרת ligands חלבון translocator עבור PET ו SPECT. עתידי שלאחר המוות מותח רקמות המוח מחקרים באמצעות כימות חלבון שמטרתו להבהיר מסלולים מטבוליים דלקתיים, ציטוקינים CNS וקולטנים מחייב שלהם, בהפרעות פסיכיאטריות יש צורך לקדם את ההבנה שלנו של פתופיזיולוגיה אוטואימונית.
תפקיד של תרופות אנטי דלקתיות בהפרעות פסיכיאטריות
מספר מחקרים אנושיים ובעלי חיים מראים שתרופות אנטי-דלקתיות מסוימות עשויות למלא תפקיד חשוב נוסף בטיפול בהפרעות פסיכיאטריות (טבלה 3). התרופות הנפוצות הן מעכבי cyclooxygenase (3) (238-245), מינוציקלין (טבלה 3) [240-245], חומצות שומן אומגה-3 [246,247] ונוירואסטרואידים [248].
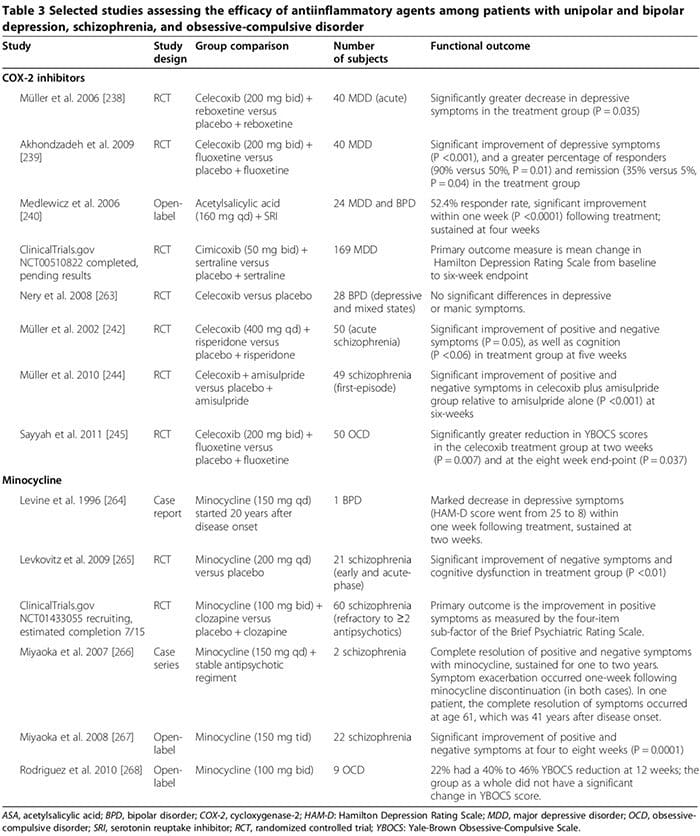 מספר מחקרים בבני אדם הראו כי מעכבי COX-2 יכולים לשפר את הסימפטומים הפסיכיאטריים של MDD, BPD, סכיזופרניה ו- OCD (טבלה 3) [248]. לעומת זאת, טיפול משלים במעכבי COX שאינם סלקטיביים (כלומר, תרופות נוגדות דלקת לא סטרואידים) (NSAID)) עשוי להפחית את היעילות של SSRI [249,250]; שני ניסויים גדולים דיווחו כי חשיפה ל- NSAIDs (אך לא למעכבי COX-2 סלקטיביים או לסליצילטים) נמצאה קשורה בהידרדרות משמעותית של דיכאון בקרב תת קבוצה של משתתפי המחקר [249,250].
מספר מחקרים בבני אדם הראו כי מעכבי COX-2 יכולים לשפר את הסימפטומים הפסיכיאטריים של MDD, BPD, סכיזופרניה ו- OCD (טבלה 3) [248]. לעומת זאת, טיפול משלים במעכבי COX שאינם סלקטיביים (כלומר, תרופות נוגדות דלקת לא סטרואידים) (NSAID)) עשוי להפחית את היעילות של SSRI [249,250]; שני ניסויים גדולים דיווחו כי חשיפה ל- NSAIDs (אך לא למעכבי COX-2 סלקטיביים או לסליצילטים) נמצאה קשורה בהידרדרות משמעותית של דיכאון בקרב תת קבוצה של משתתפי המחקר [249,250].
בניסוי הראשון, שעסקו בחולי 1,258 מדוכאים שטופלו ב- citalopram במשך 12 שבועות, שיעור ההפוגה היה נמוך משמעותית בקרב אלו שנטלו NSAIDs לפחות פעם אחת ביחס לאלה שלא היו (45 לעומת 55%, OR 0.64, P = 0.0002) [249]. הניסוי השני, שכלל נושאי 1,545 MDD, הראה כי שיעור הדיכאון העמיד לטיפול היה גבוה משמעותית בקרב אלו הנוטלים NSAIDs (1.55, 95% CI 1.21 ל- 2.00) [231]. הרעה של דיכאון בקבוצות NSAID לא יכולה להיות קשורה באופן מכני לטיפול NSAID, אך במקום זאת היא קשורה לתופעות רפואיות כרוניות הקיימות [10,12-18] המחייבות NSAIDs לטווח ארוך ואשר ידועות כקשורות באופן עצמאי לסיכון מוגבר של דיכאון עמיד לטיפול [249,251]. מחקרים עתידיים לחקור את ההשפעה של NSAIDs על דיכאון בתגובה על תרופות נוגדות דיכאון בבני אדם נדרשים.
במחקרים ניסויים אחרים המשתמשים בפרדיגמות של מתח חריף כדי לגרום למצב דמוי דיכאון בעכברים, סיטלופרם הגביר את TNF-?, IFN-? ו-p11 (גורם מולקולרי הקשור להתנהגות דיכאונית בבעלי חיים) בקורטקס הקדמי, בעוד שה-NSAID איבופרופן הפחתת מולקולות אלו; NSAIDs גם החלישו את ההשפעות נוגדות הדיכאון של SSRIs אך לא תרופות נוגדות דיכאון אחרות [249]. ממצאים אלו מצביעים על כך שציטוקינים פרו-דלקתיים עשויים באופן פרדוקסלי להפעיל השפעות נוגדות דיכאון למרות עדויות מוחצות מ�מחקרים אנושיים להיפך (כפי שנסקר לעיל), אשר יכול להיות מוחלש על ידי NSAIDs [249]. לפחות שני שיקולים עשויים להסביר את הפרדוקס הנראה לעין: 1) בתנאים ניסויים מסוימים, ציטוקינים פרו-דלקתיים נקשרו לתפקיד נוירו-פרוטקטיבי, [251; (עבור�לדוגמה, IFN-? ברמות נמוכות יכול לגרום למיקרוגליה פרוטקטיבית (איור 2) [163,166,251]); ו-2) האם התגובות הללו שנצפו בהקשר של פרדיגמת מתח חריפה במודל של בעלי חיים ישימות ל-MDD אנדוגני בבני אדם עדיין לא ברורה [251].
ההשפעות הטיפוליות של מעכבי COX-2 בהפרעות פסיכיאטריות עשויות לכלול אפנון ביוסינתזה של פרוסטגלנדינים שמקורם ב-COX-2, כולל PGE2 פרו-דלקתי ו-15-deoxy-?12,14-PGJ2 (15d-PGJ2) אנטי-דלקתי [252,253]. מעכבי COX-2 יכולים להפחית דלקת בתיווך PGE2, אשר עשויה לתרום לפתופיזיולוגיה של הפרעות פסיכיאטריות [252,253]. הם עשויים גם לשנות את רמות 15d-PGJ2, ואת הפעילות של קולטן גרעיני (PPAR-?) שלו (PPAR-?) [252,253].
מספר מחקרים מצביעים על כך ש-15d-PGJ2 והקולטן הגרעיני שלו PPAR-? יכול לשמש כסמנים ביולוגיים לסכיזופרניה [253]. בחולים סכיזופרניים, רמות PGE2 בסרום מוגברות, בעוד שרמות הסרום של 15d-PGJ2 יורדות, וכך גם הביטוי של הקולטן הגרעיני שלו PPAR-? ב-PBMC [252]. בעוד שמעכבי COX-2 עשויים להגביל את ההשפעות האנטי-דלקתיות הפוטנציאליות של ה-COX-2-תלוי �15d-PGJ2/PPAR-? מסלול, הם עשויים להפחית יתרון את ההשפעות המזיקות שלו, כולל 1) הסיכון המוגבר לאוטם שריר הלב וזיהומים מסוימים (לדוגמה, ציטומגלווירוס וטוקסופלזמה גונדי) בחולים סכיזופרניים [254] ו-2) ההשפעות הפרו-אפופטוטיות שלו שנצפו ב- רקמת סרטן של אדם וחיה [255]. מנגנונים פוטנציאליים אחרים של השפעות טיפוליות של מעכבי COX-2 עשויים להיות כרוכים ביכולתם להפחית את רמות הציטוקינים פרו-דלקתיות [163], להגביל את האקסיטוטוקסיות של חומצה כינולין (כמו ב-MDD) ולהפחית את רמות ה-KYNA (כמו בסכיזופרניה) [128].
מינוציקלין יכול להיות יעיל בהפרעות פסיכיאטריות (טבלה 3) [248]. נתונים במבחנה מצביעים על כך שמינוציקלין מעכב MAP, הפרשת ציטוקינים, ביטוי COX-2/PGE-2, וסינתאז תחמוצת החנקן הניתן להשראה [256]. מינוציקלין עשוי גם לנטרל העברה עצבית גלוטמטרית ודופמינרגית לא מווסתת [256].
יעילות חומצת שומן אומגה 3 בהפרעות פסיכיאטריות אינה ברורה [248]. במטה-אנליזה משנת 2011 של 15 מחקרים אקראיים מבוקרים (916 MDD), תוספי אומגה 3 המכילים חומצה איקוספנטאנואית בשיעור של 60% (טווח מינונים של 200 עד 2,200 מ"ג/יום מעבר למינון החומצה הדוקוסהקסאנואית) הפחיתו באופן משמעותי את תסמיני הדיכאון כתסמינים דיכאוניים. טיפול משלים ל-SRIs (P <0.001) [246]. עם זאת, מטה-אנליזה שלאחר מכן הגיעה למסקנה שאין יתרון משמעותי של חומצות שומן אומגה 3 בדיכאון וכי היעילות לכאורה היא רק תוצאה של הטיית פרסום [247]. מטה-אנליזה משנת 2012 של 5 מחקרים מבוקרים אקראיים, כולל 291 משתתפי BPD, מצאה כי תסמינים דיכאוניים, אך לא מאניים, השתפרו משמעותית בקרב אלו שחולקו באקראי לחומצות שומן אומגה 3 ביחס לאלו הנוטלים פלצבו (Hedges g 0.34, P = 0.025) [257]. בניסוי אקראי מבוקר של נבדקים סכיזופרניים שבוצעו במעקב עד 12 חודשים, ציוני התסמינים החיוביים והשליליים ירדו באופן משמעותי בקרב 66 המשתתפים שחולקו באקראי לאומגה 3 ארוכת שרשרת (1.2 גרם ליום למשך 12 שבועות; P = 0.02 ו-0.01, בהתאמה) [258]; ה�החוקרים הסיקו כי אומגה 3 augmentation במהלך הקורס המוקדם של סכיזופרניה יכול גם למנוע הישנות והתקדמות המחלה [258].
מטא-אנליזה של 2012 של שבעה ניסויים מבוקרים אקראיים העריכו אומגה 3 augmentation בחולי 168 סכיזופרניים לא מצאו כל תועלת בטיפול [259]. מחברי מטא-אנליזה זו ציינו במפורש כי לא ניתן להסיק מסקנות בנוגע למניעת הישנות או למניעת התקדמות המחלה [259]. נתונים ניסיוניים מראים כי חומצה eicosapentaenoic וחומצה docosahexaenoic מתווך ההשפעות האנטי דלקתיות שלהם על ידי קידום סינתזה של rectvins ו protectins, אשר יכול לעכב חדירת ליקוציט ולהפחית את ייצור ציטוקינים [248].
נוירוסטרואידים, כולל הריון וזרם המטבוליטים, עשויים להיות בעלי תפקוד מועיל בהפרעות פסיכיאטריות מסוימות [248,260]. ב MDD, מספר מחקרים מצאו ירידה ברמות פלזמה / CSF allopregnanolone המתואמות עם חומרת סימפטומים, אשר מנורמל לאחר טיפול מוצלח עם תרופות נוגדות דיכאון מסוימות (לדוגמה, SSRIs), ואת הטיפול electroconvulsive [261]. בסכיזופרניה, רמות ההיריון במוח ניתנות לשינוי [248] ורמות allopregnanolone בסרום עלולות לעלות לאחר כמה תרופות אנטי פסיכוטיות (לדוגמה, clozapine ו- olanzapine) [260]. במהלך שלושה ניסויים אקראיים מבוקרים (100 סכיזופרניה), משך הטיפול, כ -9 שבועות), סימפטומים חיוביים, שליליים וקוגניטיביים, וכן תופעות לוואי של אקסטריפירמידה של תרופות אנטי-פסיכוטיות השתפרו משמעותית בניסוי אחד או יותר, בהשוואה לאלו שקיבלו פלצבו. בניסוי אחד, השיפור נמשך עם טיפול ארוך טווח בהריון [248]. Pregnenolone יכול לווסת את הקוגניציה וההתנהגות על ידי הפעלת פונקציה של קולטני NMDA ו- GABAA [248]. יתר על כן, allopregnanolone עשוי להפעיל השפעות נוירו-פרוטקטיות ואנטי-דלקתיות [248]. יש צורך במחקרים נוספים של RCT כדי לאשר את התועלת של סטרואידים נוירוואקטיביים בהפרעות פסיכיאטריות מוקדמות אצל בני אדם.
אנו ממתינים לתוצאות של מספר ניסויים קליניים מתמשכים החוקרים את ההשפעות הטיפוליות של חומרים אנטי דלקתיים אחרים, כולל סליצילט, מעכב NF-?B (NCT01182727); חומצה אצטילסליצילית (NCT01320982); pravastatin (NCT1082588); ו-dextromethorphan, אנטגוניסט NMDAR לא תחרותי שיכול להגביל פגיעה נוירונית דופמינרגית הנגרמת על ידי דלקת (NCT01189006).
אסטרטגיות טיפול עתידיות
למרות שטיפולים חיסוניים נוכחיים (לדוגמה, IVIG, פלזמהרזיס, קורטיקוסטרואידים וחומרים מדכאים חיסוניים) יעילים לעתים קרובות לטיפול באנצפליטידים אוטואימוניים שבהם הדלקת היא חריפה, אינטנסיבית ובעיקר ממקור אדפטיבי, יעילותם בהפרעות פסיכיאטריות קלאסיות שבהן הדלקת היא כרונית,�הרבה יותר מתון, ובעיקר ממוצא מולד, מוגבל [2]. פיתוח טיפולים חדשניים צריך לשאוף להפחתת אובדן גלייה [46,138], תוך ויסות של MAP מזיק, תוך אופטימיזציה של ריגמי T אנדוגניים מסוג T ו- MAP מועיל, במקום הדבקה בלתי-מובחנת של דלקת כפי שקורה עם תרופות החיסוניות הנוכחיות. בנוסף, פיתוח של נוגדי חמצון חזק co-adjuvant כי היה להפוך את הפגיעה חמצון בהפרעות פסיכיאטריות יש צורך.
מסקנות
אוטואימוניות עלולה לגרום למגוון של הפרעות נוירו-פסיכיאטריות שעשויות להופיע בתחילה בסימפטומים פסיכיאטריים בודדים. דלקת מולדת / אוטואימוניות עשויה להיות רלוונטית לפתוגנזה של תסמינים פסיכיאטריים בקבוצת משנה של מטופלים עם הפרעות פסיכיאטריות קלאסיות. דלקת מולדת עשויה להיות קשורה באופן מכני לתסמינים המונומינרגיים והגלוטמטריים המסורתיים ולפציעה חמצונית מוגברת המדווחת במחלות פסיכיאטריות.
סוהל נג'ארקסקסומקס *, דניאל מ 'פרלמן ננוקס, קנת אלפרקס, אמנדה נג'ארקסקס ואורין דוינסקיקס
קיצורים
3-OH-KYN: 3-hydroxy-kynurenine; ?7nAchR: קולטני אצטילכולין ניקוטיני אלפא 7; AMPAR: קולטני חומצה אמינו-3-הידרוקסי-5-מתיל-ל-4-איזוקסאזולפרופיונית; APC: תא מציג אנטיגן; BBB: מחסום דם מוח;
BH4: Tetrahydrobiopterin; BPD: הפרעה דו קוטבית; CI: מרווח ביטחון;
CNS: מערכת העצבים המרכזית; COX-2: Cyclooxegenase-2; CSF: נוזל שדרתי; DSM-IV: מדריך אבחון סטטיסטי של הפרעות נפש 4th Edition; EAATs: מסועי חומצת אמינו מעוררים; eNOS: סינתזה תחמוצת החנקן האנדותל; GABAB: גמא aminobutyric חומצה ביתא; GAD: גלוטוקס חומצה decarboxylase; GFAP: חלבון חומצה פיברילית גליאלית; GLX: 1H MLS גלוטמט לגילוי, גלוטמין, חומצה גמא aminobutyric;
IDO: Indoleamine 2,3-dioxygenase; Ig: אימונוגלובולין; IL: Interleukin; IL-1RA: אנטגוניסט לקולטן Interleukin 1; IFN-?: אינטרפרון גמא;
KAT: aminotransferase Kynurenine; KMO: Kynurenine 3-monooxygenase; KYN: Kynurenine; KYNA: חומצה Kynurenic; LE: דלקת האנצפליטיס הלימבית;
LPS: Lipopolysaccharide; MAP: הפעלה microglial התפשטות;
MDD: הפרעת דיכאון מג'ורי; mGluR: קולטן גלוטמט מטבוטרופי; MHC: II Major histocompatibility complex class two; MRI: הדמיית תהודה מגנטית; MRS: ספקטרוסקופיה של תהודה מגנטית; NF-?B: גורם גרעיני קאפה B; NMDAR: קולטן N-methyl-D-aspartate; NR1: אתר גליצין;
OCD: הפרעה אובססיבית-קומפולסיבית; או: יחס הסיכויים; PANDAS: הפרעות אוטואימוניות נוירופסיכיאטריות לילדים הקשורות לזיהומים סטרפטוקוקליים; PBMC: תאי דם מונונוגרעיניים היקפיים; PET: טומוגרפיה פליטת פוזיטרונים; PFC: קליפת המוח הפריפרונטלית; PGE-2: Prostaglandin E2; PPAR-
?: גמא קולטן גרעיני המופעל על ידי Peroxisome proliferator; QA: חומצה קווינולינית; RNS: מיני חנקן תגובתיים; ROS: מיני חמצן תגובתיים;
sIL: אינטרלוקין מסיס; SLE: מערכתית לופוס אריתמטוזוס; SRI: מעכב ספיגה חוזרת של סרוטונין; TNF-?: Tumor necrosis factor alpha; T-regs: CD4+CD25 +FOXP3+ T תאים רגולטוריים; TDO: טריפטופן-2,3-דיאוקסיגנאז; Th: T-helper; VGKC: תעלת אשלגן מגודרת במתח; XAG-: טרנספורטר גלוטמט אספרטאט; Xc-: גלוטמט/ציסטין אסטרוגליאלי בלתי תלוי בנתרן
מערכת אנטי
אינטרסים מתחרים
המחברים מצהירים כי אין להם אינטרסים מתחרים.
מחברים��תרומות
SN ו- DMP ביצעו סקירה ספרותית מקיפה, פירשו נתונים, הכינו את כתב היד, הדמויות והשולחנות. כ"א הכינה את הקטע הנוגע למנגנונים חמצוניים ותרמה לתיקוני כתב היד. AN ו OD ביקורתית המתוקן ושיפר את העיצוב ואת האיכות של כתב היד. כל המחברים קראו ואישרו את כתב היד הסופי.
תודות
אנו מודים בהכרת תודה לדוקטור. ד"ר ג'וזף דאלמאו, MD, PhD, טרייסי באטלר, MD, ודוד זאזג, MD, PhD, על מתן המומחיות שלהם באנצפליטידים אוטואימוניות, הדמייה נוירו-דלקתית ונוירופתולוגיה, בהתאמה.
מחבר�פרטים
1 המחלקה Neurology, ניו יורק אוניברסיטת הספר לרפואה, 550 השדרה הראשונה, ניו יורק, ניו יורק 10016, ארה"ב. 2Geisel בית הספר לרפואה ב Dartmouth, מכון דרטמות 'למדיניות בריאות ומרפאה קלינית, 30 Lafayette רחוב, HB 7252, לבנון, NH 03766, ארה"ב. 3 מחלקת הפאתולוגיה, המחלקה לנוירופתולוגיה, בית הספר לרפואה של אוניברסיטת ניו יורק, 550 השדרה הראשונה, ניו יורק, ניו יורק 10016, ארה"ב. המחלקה לפסיכיאטריה, אוניברסיטת ניו יורק, ניו יורק, ניו יורק, ארה"ב. 4New ניו יורק אוניברסיטת אפילפסיה מרכז, 5 השדרה הראשונה, ניו יורק, ניו יורק 550, ארה"ב.
רֵיק
הפניות:
1. Kayser MS, Dalmau J: הקשר המתפתח בין הפרעות אוטואימוניות
ומחלות נוירופסיכיאטריות. J Neuropsychiatry Clin Neurosci 2011, 23:90-97.
2. נג'אר ס ', פרלמן ד', זגזג ד ', גולפינוס י', דווינסקי O: חומצה גלוטמית
תסמונת אוטואינטיבודיס דקרבוזילס המציגה סכיזופרניה.
נוירולוג 2012, 18:88�91.
3. גראוס F, Saiz A, Dalmau י: נוגדנים ואוטימוניות עצבית
הפרעות של מערכת העצבים המרכזית. J Neurol 2010, 257:509�517.
4. Lennox BR, Coles AJ, וינסנט A: נוגדנים בתיווך דלקת המוח: א
סיבה ניתנת לטיפול לסכיזופרניה. Br J Psychiatry 2012, 200:92�94.
5. Zandi MS, אירני SR, Lang B, ווטרס P, ג 'ונס PB, מק' קנה P, קולס AJ, וינסנט
A, לנוקס BR: נוגדנים עצמיים רלוונטיים למחלה בפרק הראשון
סכִיזוֹפרֶנִיָה. J Neurol 2011, 258:686�688.
6. Bataller L, Kleopa KA, Wu GF, רוסי JE, רוזנפלד MR, Dalmau J:
אוטואימבוס לימבי אוטואימוניות בחולי 39: אימונופנוטיפים ו
תוצאות. J Neurol Neurosurg Psychiatry 2007, 78:381-385.
7. דייל RC, היימן אני, Giovannoni G, הכנסייה AW: שכיחות של אנטי מוח
נוגדנים אצל ילדים עם הפרעה אובססיבית-כפייתית. בר פסיכיאטריה
2005, 187: 314 319.
8. קנדלר KS: אופי מנומר של סיבות למחלה פסיכיאטרית: החלפת
את הדיכוטומיה האורגנית-תפקודית / חומרה-תוכנה עם אמפירית
פלורליזם מבוסס. מול פסיכיאטריה 2012, 17:377�388.
9. קסקין G, Sunter G, Midi I, Tuncer N: Neurosyphilis כגורם של קוגניטיבית
ירידה בסימפטומים פסיכיאטריים בגיל צעיר יותר. מרפאה נוירופסיכיאטרית
Neurosci 2011, 23:E41�E42.
10. Leboyer M, Soreca I, סקוט J, Frye M, הנרי C, Tamouza R, קופפר DJ: יכול
הפרעה דו קוטבית להיות נתפס מחלה רב מערכתית דלקתית?
J Affect Disord 2012, 141:1�10.
11. Hackett ML, Yapa C, Parag V, אנדרסון CS: תדירות הדיכאון לאחר
שבץ מוחי: סקירה שיטתית של מחקרי תצפית. Stroke 2005, 36:1330�1340.
12. Dantzer R, O'Connor JC, פרוינד GG, ג 'ונסון RW, Kelley KW: מ
דלקת למחלות ודיכאון: כאשר המערכת החיסונית
מכפיף את המוח. Nat Rev Neurosci 2008, 9:46–56.
13. Laske C, זנק M, קליין R, Stransky E, Batra A, Buchkremer G, Schott K:
תגובת נוגדנים עצמיים בסרום של חולים עם דיכאון גדול,
סכיזופרניה ובקרות בריאות. Psychiatry Res 2008, 158:83�86.
14. אייזנברגר NI, ברקמן ET, Inagaki TK, Rameson LT, משעל NM, אירווין MR:
דלקת הנגרמת על ידי דלקות: אנדוטוקסין מפחית את הסטריאטום הגחוני
תגובות לתגמול. ביול פסיכיאטריה 2010, 68:748-754.
15. הארון E, רייסון CL, מילר אה: Psychoneuroimmunology פוגש
Neuropsychopharmacology: השלכות translational של ההשפעה של
דלקת בהתנהגות. Neuropsychopharmacology 2012, 37:137-162.
16. Benros ME, Nielsen יחסי ציבור, Nordentoft M, איטון WW, דלתון SO, Mortensen PB:
מחלות אוטואימוניות וזיהומים חמורים כגורמי סיכון
סכיזופרניה: מחקר מרשם אוכלוסין מבוסס 30 לשנה. Am J פסיכיאטריה
2011, 168: 1303 1310.
17. מקנאלי L, Bhagwagar Z, Hannestad J: דלקת, גלוטמט, גליה
בדיכאון: סקירת ספרות. CNS Spectr 2008, 13:501�510.
18. הריסון אן, ברידון L, ווקר C, גריי MA, Steptoe A, Critchley HD:
דלקת גורמת שינויים במצב הרוח באמצעות שינויים subgenual
cingulate פעילות קישוריות mesolimbic. Biol פסיכיאטריה 2009,
66:407�414.19. Raison CL, Miller AH: האם דיכאון הוא הפרעה דלקתית?
Curr Psychiatry Rep 2011, 13:467�475.
20. רייסון CL, מילר AH: המשמעות האבולוציונית של דיכאון ב
Pathogen Host Defense (PATHOS-D). מול פסיכיאטריה 2013, 18:15�37.
21. Steiner J, Bogerts B, Sarnyai Z, וולטר M, Gos T, ברנשטיין HG, Myint AM:
גישור הפער בין ההשערות החיסונית וגלוטמט של
סכיזופרניה ודיכאון מרכזי: תפקיד פוטנציאלי של NMDA גליה
מאפננים קולטן ופגיעה בשלמות מחסום הדם במוח. עולם J
ביול פסיכיאטריה 2012, 13:482�492.
22. Steiner J, Mawrin C, Ziegeler A, Bielau H, אולריך O, ברנשטיין HG, Bogerts B:
התפלגות של microglia חיובי HLA-DR בסכיזופרניה משקף
לרוחב מוחי לקוי. Acta Neuropathol 2006, 112:305�316.
23. Papakostas GI, Shelton RC, Kinrys G, הנרי ME, Bakow BR, Lipkin SH, Pi B,
Thurmond L, Bilello JA: הערכה של רב assay, מבוסס בסרום
מבחן אבחון ביולוגי להפרעת דיכאון מרכזית: טייס ו
מחקר שכפול. מול פסיכיאטריה 2013, 18:332�339.
24. קרישנן R: דיכאון חד קוטבי במבוגרים: אפידמיולוגיה, פתוגנזה ו
נוירוביולוגיה. ב - UpToDate. נערך על ידי Basow DS. Waltham, MA: UpToDate; 2013.
25. Stovall J: הפרעה דו קוטבית אצל מבוגרים: אפידמיולוגיה ואבחון. ב
עדכני. נערך על ידי Basow DS. עדכן: Waltham; 2013.
26. פישר BA, Buchanan RW: סכיזופרניה: אפידמיולוגיה ופתוגנזה.
ב - UpToDate. נערך על ידי Basow DS. Waltham, MA: UpToDate; 2013.
27. Nestadt G, Samuels J, Riddle M, Bienvenu OJ 3rd, ליאנג KY, LaBuda M,
Walkup J, Grados M, Hoehn-Saric R: מחקר משפחתי של אובססיבי קומפולסיבי
הפרעה. Arch Gen Psychiatry 2000, 57:358�363.
28. Stefansson H, Ophoff RA, שטיינברג S, אנדריאסן OA, Cichon S, Rujescu D,
Werge T, Pietilainen OP, Mors O, Mortensen PB, סיגורדסון E, Gustafsson O,
Nyegaard M, Tuulio-Henriksson A, Ingason A, Hansen T, Suvisaari J,
Lonnqvist J, Paunio T, B�rglum AD, Hartmann A, Fink-Jensen A, Nordentoft
M, Hougaard D, Norgaard-Pedersen B, B�ttcher Y, Olesen J, Breuer R, M�ller
HJ, Giegling I, et al: גרסאות שכיחות המעניקות סיכון לסכיזופרניה.
טבע 2009, 460:744�747.
29. M�ller N, Schwarz MJ: השינוי בתיווך החיסון של סרוטונין ו
גלוטמט: לכיוון תצוגה משולבת של דיכאון. מולטי פסיכיאטריה
2007, 12: 988 1000.
30. Galecki P, Florkowski A, Bienkiewics M, Szemraj J: פולימורפיזם פונקציונלי
של הגן cyclooxygenase-2 (G-765C) בחולים מדכאים.
נוירופסיכוביולוגיה 2010, 62:116-120.
31. לוינסון DF: הגנטיקה של דיכאון: סקירה. Biol פסיכיאטריה 2006,
60: 84 92.
32. ג'איי J, צ'נג L, דונג J, שן ש, ג'אנג ש, חן M, גאו L, חן X, וואנג K,
דנג X, שו Z, J F, Liu C, Li J, דונג Q, חן C: S100B הגן
פולימורפיזמים מנבאים תפקוד מרחבי פריפרונטאלי בשני הסכיזופרניה
חולים ואנשים בריאים. Schizophres 2012, 134:89 �94.
33. ג'איי J, ג'אנג Q, צ'נג L, חן M, וואנג ק, ליו Y, דנג X, חן X, שן Q,
שו Z, J F, Liu C, דונג Q, חן C, Li J: גרסאות הסיכון של הגן S100B,
הקשורים רמות גבוהות S100B, קשורות גם עם
מוגבלות ויזו-מרחבית של סכיזופרניה. Behav Brain Res 2011, 217:363�368.
34. Cappi C, מוניז RK, Sampaio AS, Cordeiro Q, Brentani H, Palacios SA,
Marques AH, Vallada H, מיגל EC, Guilherme L, Hounie AG: האגודה
מחקר בין פולימורפיזם פונקציונלי בגן TNF-alpha
הפרעה אובססיבית-קומפולסיבית. Arq Neuropsiquiatr 2012, 70:87�90.
35. מיגל- Hidalgo JJ, Baucom C, Dilley G, Overholser JC, מלצר היי,
Stockmeier CA, Rajkowska G: חלבון חומצה fibriillary גליה
אימונו-אקטיביות בקורטקס הפריפרונטאלי מבדיל בין הצעירים מ
מבוגרים בהפרעת דיכאון מג'ורי. Biol Psychiatry 2000, 48:861�873.
36. Altshuler LL, Abulseoud OA, Foland Ross L, Bartzokis G, Chang S, מינץ J,
Hellemann G, Vinters HV: ירידה באסטרוגדלה באסטרדלה בנבדקים עם
הפרעת דיכאון גדולה, אך לא הפרעה דו קוטבית. הפרעה דו קוטבית 2010,
12: 541 549.
37. Webster MJ, Knable MB, Johnston-Wilson N, Nagata K, Inagaki M, Yolken RH:
לוקליזציה אימונוהיסטוכימי של חומצה פיברילורית phosphorylated גליה
חלבון בקורטקס הפריפרונטאלי והיפוקמפוס מחולים עם
סכיזופרניה, הפרעה דו קוטבית ודיכאון. המוח Behav Immun 2001,
15: 388 400.
38. Doyle C, Deakin JFW: פחות אסטרוציטים בקורטקס חזיתית בסכיזופרניה,
דיכאון והפרעה דו קוטבית. סכיזופרניה Res 2002, 53: 106.
39. ג 'ונסטון, וילסון NL, סימס CD, הופמן JP, אנדרסון L, שור AD, טורי
EF, Yolken RH: שינויים ספציפיים למחלות בחלבונים המוחיים בקליפת המוח הקדמית
ב סכיזופרניה, הפרעה דו קוטבית, הפרעת דיכאון גדולה,
סטנלי נוירופתולוגיה קונסורציום. מול פסיכיאטריה 2000, 5:142�149.
40. Gosselin RD, Gibney S, O'Malley D, דינן TG, Cryan JF: אזור ספציפי
ירידה בחלבון פיברילרי חומצה immunoreactivity גלובלי במוח של
מודל חולדה של דיכאון. מדעי המוח 2009, 159:915�925.
41. Banasr M, Duman RS: אובדן גליה בקליפה הפריפרונטאלית מספיקה
לגרום להתנהגויות דמויות דיכאון. Biol Psychiatry 2008, 64:863�870.
42. Cotter D, הדסון L, לנדאו S: עדות לפטולוגיה אורביטופרונלית ב
הפרעה דו קוטבית ודיכאון גדול, אך לא בסכיזופרניה.
הפרעה דו קוטבית 2005, 7:358-369.
43. בראון ר ', עדנאן אל-מסרי ז', פרקר ג'וניור, אל-מלאך ר ': מספר תא גליה
ו תאי נוירון / גליה תאים במוח שלאחר המוות של אנשים דו קוטבית.
J Affect Disord 2006, 91:87�90.
44. Cotter DR, Pariante CM, Everall IP: הפרעות בתאי גלייה העיקריים
הפרעות פסיכיאטריות: הראיות וההשלכות. המוח בול בול 2001,
55: 585 595.
45. Cotter D, מקאי D, לנדאו S, קרווין R, Everall אני: צפיפות תא גלייה מופחתת
וגודל נוירונים בקורטקס הסינגולי הקדמי בדיכאון עיקרי
הפרעה. Arch Gen Psychiatry 2001, 58:545�553.
46. Bowley MP, Drevets WC, Ong�r D, Price JL: מספרי גליה נמוכים ב-
אמיגדלה בהפרעת דיכאון מג'ורי. Biol Psychiatry 2002, 52:404�412.
47. טורו CT, Hallak JE, דנהם JS, Deakin JF: חלבון חומצה fibriillary גליה ו
גלוטמין synthetase ב subregions של קורטקס הפריפרונטלי בסכיזופרניה
והפרעת מצב רוח. Neurosci Lett 2006, 404:276�281.
48. Rajkowska G, מיגל- Hidalgo JJ, Makkos Z, מלצר H, Overholser J,
Stockmeier C: הנחות ספציפיות בשכבות באסטרוגליה GFAP-reactive ב
קליפת מוח קדם-מצחית דורסולטרלית בסכיזופרניה. Schizophres 2002, 57:127-138.
49. Steffek AE, McCullumsmith RE, Haroutunian V, Meador-Woodruff JH: קליפת המוח
ביטוי של חלבון חומצי פיבריללי גליה ו synuttase גלוטמין הוא
ירידה בסכיזופרניה. Schizophres 2008, 103:71�82.
50. Dadadzic R, Bigelow LB, קרימר LS, גולדנסון DA, סונדרס RC, קליינמן
י"א, הרמן MM: מחקר immunohistochemical כמותי של האסטרוציטים ב
הקורטקס האנטורינאלי בסכיזופרניה, הפרעה דו קוטבית ומייג'ור
דיכאון: היעדר אסטרוציטוזיס משמעותי. Brain Res Bull 2001, 55:611�618.
51. Benes FM, McSparren J, ציפור ED, SanGiovanni JP, וינסנט SL: גרעונות ב
intereurons קטן ב prefrontal ו cingulate קורטקס של סכיזופרניה
וחולים סכיזואפקטיביים. Arch Gen Psychiatry 1991, 48:996-1001.
52. M�ller N, Schwarz MJ: מערכת החיסון וסכיזופרניה. קור אימונול
Rev 2010, 6:213�220.
53. שטיינר י ', וולטר ז, גוס טי, גילימין GJ, ברנשטיין HG, Sarnyai Z, Mawrin C,
Brisch R, Bielau H, Meyer Zu Schwabedissen L, Bogerts B, Myint AM: חמור
דיכאון קשורה עם מוגברת חומצה quinolinic microglial ב
אזורי משנה של gyrus cingulate הקדמי: ראיות עבור immunemodulated
נוירוטרנסמינציה glutamatergic? J 2011, 8: 94.
54. Vostrikov VM, אורנובה NA, Orlovskaya DD: הגירעון של perineuronal
oligodendrocytes בקורטקס הפריפרונטלי בסכיזופרניה ומצב הרוח
הפרעות. Schizophres 2007, 94:273-280.
55. Rajkowska G, מיגל, Hidalgo JJ: Gliogenesis ו פתולוגיה גליה ב
דִכָּאוֹן. CNS Neurol Disord Drug Targets 2007, 6:219�233.
56. Uranova NA, Vostrikov VM, אורלובסקיה DD, רחמנובה השישי:
צפיפות Oligodendroglial בקליפה הפריפרונטאלית בסכיזופרניה ו
הפרעות במצב הרוח: מחקר מקונסורציום סטנלי נוירופתולוגיה.
Schizophres 2004, 67:269-275.
57. Uranova N: נזק ואובדן של oligodendrocytes הם קריטיים
פתוגנזה של סכיזופרניה והפרעות במצב הרוח (טופס הממצאים
שלאחר המוות). Neuropsychopharmacology 2004, 29: S33.
58. Uranova NA, אורלובסקאיה DD, Vostrikov VM, רחמנובה השישי: ירידה
צפיפות של לווינים oligodendroglial של נוירונים פירמידליים בשכבה III ב
קליפת המוח הפריפרונטלית בסכיזופרניה והפרעות במצב הרוח. סכיזופר
2002, 53: 107.
59. Vostrikov VM, אוראנובה NA, רחמנובה השישי, אורלובסקאיה DD: הוריד
צפיפות תאים oligodendroglial בקליפה הפריפרונטאלית בסכיזופרניה.
Zh Nevrol Psikhiatr Im SS Korsakova 2004, 104:47�51.
60. Uranova NA, Zimina IS, Vikhreva OV, Krukov NO, רחמנובה השישי, אורלובסקאיה
DD: נזק Ultrastructural נימים ב הניאוקורטקס ב
סכִיזוֹפרֶנִיָה. World J Biol Psychiatry 2010, 11:567-578.
61. הוף PR, Haroutunian V, פרידריך VL ג 'וניור, Byne W, Buitron C, Perl DP, דייוויס KL:
אובדן ושינוי התפלגות מרחבית של oligodendrocytes ב מעולה
גירוס חזיתי בסכיזופרניה. ביול פסיכיאטריה 2003, 53:1075�1085.
62. דייויס KL, סטיוארט DG, פרידמן JI, Buchsbaum M, הארווי PD,
Buxbaum J, Harutunian V: חומר לבן שינויים בסכיזופרניה:
ראיות לתפקוד לקוי של מיאלין. Arch Gen Psychiatry 2003,
60:443�456.63. Flynn SW, Lang DJ, Mackay AL, Goghari V, Vavasour IM, Whittall KP, Smith
GN, Arango V, מאן ג'יי ג'יי, DWORK AJ, Falkai P, כבוד WG: חריגות של
מיאלינציה בסכיזופרניה שזוהתה ב- vivo עם MRI, שלאחר המוות
עם ניתוח של חלבונים oligodendrocyte. Mol פסיכיאטריה 2003,
8: 811 820.
64. Uranova NA, Vostrikov VM, Vikhreva OV, Zimina IS, קולומיטים NS, אורלובסקאיה
DD: תפקיד הפתולוגיה oligodendrocyte בסכיזופרניה. Int J
Neuropsychopharmacol 2007, 10:537-545.
65. Byne W, Kidkardnee S, Tatusov A, Yiannoulos G, Buchsbaum MS,
Harutunian V: סכיזופרניה הקשורים הפחתת נוירונים ו
מספרים oligodendrocyte בגרעין התלמי הקדמי העיקרי.
Schizophres 2006, 85:245-253.
66. Hamidi M, Drevets WC, מחיר JL: ירידה Glial ב amygdala הגדולות
הפרעת דיכאון היא בשל oligodendrocytes. Biol פסיכיאטריה 2004,
55: 563 569.
67. Bayer ת"א, Buslei R, Havas L, Falkai P: עדויות ההפעלה של microglia ב
חולים עם מחלות פסיכיאטריות. Neurosci Lett 1999, 271:126-128.
68. שטיינר י, ביאלאו ה ', בריש R, Danos P, Ullrich O, Mawrin C, ברנשטיין HG,
בוגרטס B: היבטים אימונולוגיים בנוירוביולוגיה של התאבדות:
מוגברת צפיפות microglial בסכיזופרניה ודיכאון הוא
קשור להתאבדות. J Psychiatr Res 2008, 42:151-157.
69. Rao JS, הארי GJ, Rapoport SI, קים HW: excitotoxicity מוגברת ו
סמנים נוירו-דלקתיים בקורטקס הפרונטלי שלאחר המוות מ דו קוטבית
חולי הפרעה. מול פסיכיאטריה 2010, 15:384�392.
70. ברנשטיין HG, שטיינר J, Bogerts B: תאים Glial בסכיזופרניה:
משמעות פתופיזיולוגית ותוצאות אפשריות לטיפול.
Expert Rev Neurother 2009, 9:1059�1071.
71. חן SK, Tvrdik P, פדן E, צ 'ו S, וו S, Spangrude G, Capecchi MR:
המוצא ההמטופואי של הטיפוח הפתולוגי בעכברים מוטנטים Hoxb8.
תא 2010, 141:775�785.
72. אנטוני JM: טיפוח וטיפוח עם microglia. Sci אותות 2010, 3: jc8.
73. וונודי I, Stine OC, Sathyasaikumar KV, רוברטס RC, מיטשל BD, הונג לה,
Kajii Y, Thaker GK, Schwarcz R: downnulated kynurenine 3-
monooxygenase ביטוי גנים ופעילות אנזים בסכיזופרניה
ואגודה גנטית עם endophenotypes סכיזופרניה. ארץ
פסיכיאטריה 2011, 68:665�674.
74. רייסון CL, לורי CA, Rook GA: דלקת, תברואה, ו
תדהמה: איבוד מגע עם מתפתל, סובלני
מיקרואורגניזמים ו פתופיזיולוגיה וטיפול העיקריים
דִכָּאוֹן. Arch Gen Psychiatry 2010, 67:1211�1224.
75. Drexhage RC, Hoogenboezem TH, Versnel MA, Berghout A, Nolen WA,
Drexhage HA: הפעלה של רשתות מונוציטים ותאי T בחולים
עם הפרעה דו קוטבית. Brain Behav Immun 2011, 25:1206�1213.
76. שטיינר J, ג'ייקובס R, Panteli B, Brauner M, Schiltz K, Bahn S, Herberth M,
ווסטפל S, Gos T, וולטר M, ברנשטיין HG, Myint AM, Bogerts B: חריפה
סכיזופרניה מלווה בתאי T מופחת ובתא B מוגבר
חֲסִינוּת. Eur Arch Psychiatry Clin Neurosci 2010, 260:509�518.
77. רוט JY, Aouizerate B, Tignol J, Bioulac B, Burbaud P, Guehl D:
השערת החיסון הגנטי המבוססת על גלוטמאט באובססיבי-קומפולסיבי
הפרעה, גישה אינטגרטיבית מגנים לסימפטומים.
מדעי המוח 2010, 165:408�417.
78. Y�ksel C, Ong�r D: מחקרי ספקטרוסקופיה של תהודה מגנטית של
גלוטמט הקשורות הפרעות בהפרעות במצב הרוח. Biol פסיכיאטריה 2010,
68: 785 794.
79. ראו JS, Kellom M, ריס EA, Rapoport SI, קים HW: גלוטמט Dysregulated
ו דופמין מובילים קליפת המוח הקדמית שלאחר המוות מ דו קוטבית
וחולים סכיזופרניים. J Affect Disord 2012, 136:63�71.
80. באואר ד, גופטא D, Harotunian V, Meador-Woodruff JH, McCullumsmith RE:
ביטוי חריג של טרנספורטר גלוטמט ו טרנספורטר
מולקולות אינטראקציה בקורטקס הפריפרונטלי בחולים מבוגרים עם
סכִיזוֹפרֶנִיָה. Schizophres 2008, 104:108-120.
81. C, מלון M, Vallejo-Illarramendi A, Conti F: ביטוי מוגבר
של משדר גלוטמט astrocytic GLT-1 בקליפה הפריפרונטלית של
סכיזופרנים. 2005, 49:451�455.
82. סמית רי, Harutunian V, דייוויס KL, Meador-Woodruff JH: הביטוי של
תחליפי חומצות אמינו נרגשות בתלמוס של הנבדקים
עם סכיזופרניה. Am J Psychiatry 2001, 158:1393-1399.
83. McCullumsmith RE, Meador-Woodruff JH: חומצת אמינו סטריטלית
ביטוי תמליל טרנספורמציה בסכיזופרניה, הפרעה דו קוטבית,
והפרעה דיכאונית גדולה. Neuropsychopharmacology 2002,
26: 368 375.
84. Pittenger C, בלוך MH, וויליאמס K: גלוטמט חריגות אובססיבית
הפרעה כפייתית: נוירוביולוגיה, פתופיזיולוגיה וטיפול.
Pharmacol Ther 2011, 132:314�332.
85. Hashimoto K: תפקיד מתפתח של גלוטמט ב פתופיזיולוגיה של
הפרעה דכאונית קשה. Brain Res Rev 2009, 61:105�123.
86. Hashimoto K, Sawa A, Iyo M: רמות מוגברות של גלוטמט במוח מ
חולים עם הפרעות מצב רוח. ביול פסיכיאטריה 2007, 62:1310�1316.
87. Burbaeva G, Boksha IS, Turishcheva MS, Vorobyeva EA, Savushkina אישור,
Tereshkina EB: גלוטמין synthetase ו glutamate dehydrogenase ב
קליפת המוח הקדם-פרונטאלית של חולי סכיזופרניה. Prog
Neuropsychopharmacol Biol Psychiatry 2003, 27:675-680.
88. Bhattacharyya S, קאנה S, Chakrabarty K, Mahadevan א, כריסטופר R,
Shankar SK: נוגדנים עצמיים נוגדי מוח ושינויים מעוררים
נוירוטרנסמיטורים בהפרעה אובססיבית-קומפולסיבית.
Neuropsychopharmacology 2009, 34:2489�2496.
89. Sanacora G, Gueorguieva R, Epperson CN, וו YT, אפל M, Rothman DL,
קריסטל JH, מייסון GF: משנה ספציפי שינויים של gammaaminobutyric
חומצה וגלוטמט בחולים עם דיכאון גדול.
Arch Gen Psychiatry 2004, 61:705-713.
90. מרסמן א, ואן דן היובל MP, Klomp DW, Kahn RS, Luijten יחסי ציבור, Hulshoff
פוליאסטר: גלוטמט בסכיזופרניה: סקירה ממוקדת ומטה-אנליזה
של מחקרי 1H-MRS. סכיזופר בול 2013, 39:120�129.
91. Liu Y, הו RC, Mak A: אינטרליוקין (IL) -6, גורם נמק הגידול אלפא
(TNF-alpha) ו interleukin- קולטני 2 מסיסים (sIL-2R) הם גבוהות ב
מטופלים עם הפרעת דיכאון מרכזית: מטא-אנליזה ומטרגרסיביות.
J Affect Disord 2012, 139:230�239.
92. Brietzke E, Stabellini R, Grassis-Oliveira R, Lafer B: ציטוקינים דו קוטביים
הפרעה: ממצאים אחרונים, השפעות מזיקות אך הבטחות לעתיד
תוֹרַת הָרִפּוּי. CNS Spectr 2011. www.cnsspectrums.com/aspx/
articledetail.aspx? articlesid = 3596.
93. Denys D, Fluitman S, Kavelaars A, Heijnen C, Westenberg H: ירידה
TNF-alpha ו- NK בפעילות הפרעה אובססיבית-קומפולסיבית.
Psychoneuroendocrinology 2004, 29:945-952.
94. Brambilla F, Perna G, Bellodi L, Arancio C, ברטני A, פריני G, Carraro C, גווה
F: פלזמה interleukin-1 בטא וריכוז גורם נמק הגידול
הפרעות אובססיביות-קומפולסיביות. Biol Psychiatry 1997, 42:976-981.
95. Fluitman S, Denys D, Vulink N, Schutters S, Heijnen C, Westenberg H:
Lipopolysaccharide-induced ציטוקינים הייצור ב אובססיבי קומפולסיבי
הפרעה והפרעת חרדה חברתית כללית. פְּסִיכִיאָטרִיָה
Res 2010, 178:313�316.
96. Janelidze S, Mattei D, ווסטרין A, Traskman-Bendz L, ברונדין L: ציטוקינים
רמות בדם עשויות להבחין בין ניסיונות התאבדות מדוכאים
חולים. Brain Behav Immun 2011, 25:335�339.
97. דואר M, Costallat LT, Appenzeller S: תופעות נוירופסיכיאטריות ב
זאבת מערכתית: אפידמיולוגיה, פתופיזיולוגיה ו
הַנהָלָה. CNS Drugs 2011, 25:721�736.
98. Kozora E, הנלי JG, Lapteva L, Filley CM: תפקוד קוגניטיבי ב
זאבת מערכתית: עבר, הווה ועתיד.
Arthritis Rheum 2008, 58:3286�3298.
99. לנקסטר E, Martinez-Hernandez E, Dalmau J: אנקפליטיס ונוגדנים ל
חלבונים על פני השטח של תאים סינפטיים ונוירונים. נוירולוגיה 2011, 77:179�189.
100. דלמאו, לנקסטר א, מרטינז-הרננדז, רוזנפלד מ.ר., בליס גורדון
R: ניסיון קליני חקירות מעבדה בחולים עם AntiMMDAR
דַלֶקֶת הַמוֹחַ. Lancet Neurol 2011, 10:63�74.
101. Lai M, Huijbers MG, Lancaster E, Graus F, Bataller L, Balice-Gordon R, Cowell
JK, Dalmau J: חקירה של LGI1 כאנטיגן בדלקת המוח
שיוחסו בעבר לערוצי אשלגן: סדרת מקרים. לנסט ניורול
2010, 9: 776 785.
102. Lancaster E, Huijbers MG, Bar V, Boronat A, וונג A, Martinez-Hernandez E,
ווילסון ג ', ג' ייקובס D, לאיי M, ווקר RW, גראוס F, Bataller L, אילה אני, מרקס S, שטראוס
KA, פלס E, Scherer SS, Dalmau J: חקירות של caspr2, autoantigen של
דלקת המוח ונוירומיוטוניה. אן נוירול 2011, 69:303�311.
103. Lancaster E, Lai M, Peng X, יוז E, קונסטנטינסקו R, רייזר J, פרידמן
D, Skeen MB, גריזולד W, קימורה A, Ohta K, Iizuka T, גוזמן M, גראוס F,
MUS SJ, Balice-Gordon R, Dalmau J: נוגדנים לקולטן GABA (B)
דלקת קרום המוח עם התקפים: סדרות מקרה ואפיון
אַנְטִיגֵן. Lancet Neurol 2010, 9:67–76.
104. לנקסטר E, Martinez-Hernandez E, Titulaer MJ, בולוס M, Weaver S, אנטואן
JC, Liebers E, Kornblum C, Bien CG, Honnorat J, וונג S, שו J, הקבלן A,
Balice-Gordon R, Dalmau J: נוגדנים לגלוטמט מטבוטרופי
קולטן 5 בתסמונת אופליה. נוירולוגיה 2011, 77:1698�1701.105. Ances BM, Vitaliani R, Taylor RA, Liebeskind DS, Voloschin A, Houghton DJ,
גלאטה, דיכטר, אלבי א ', רוזנפלד מ.ר., דאלמאו י': מטפל
דלקת גידולים לימבית מזוהה על ידי נוגדנים neuropil: MRI ו
PET מתאם. Brain 2005, 128:1764–1777.
106. טופריס GK, האיראני SR, Cheran BJ, Baker IW, Cader ZM, וינסנט A:
רפואה תגובה אימונוטרית כתכונת ההצגה של LGI1-
נוגדן אנצפליטיס. נוירולוגיה 2012, 79:195�196.
107. נג'אר ס ', פרלמן ד', נג'אר א ', ג'יאסאן V, זגזג ד', דווינסקי O:
דלקת ריאות אוטואימונית אוטרימונית הקשורה בחומצה גלוטמית
נוגדנים decarboxylase: ישות underdiagnosed? התנהגות אפילפסיה
2011, 21: 306 313.
108. Titulaer MJ, McCracken L, Gabilondo I, ארמנגו T, Glaser C, Iizuka T, Honig
LS, Benseler SM, קוואצ'י אני, Martinez-Hernandez E, Aguilar E, Gresa-Arribas N,
Ryan-Florance N, Torrents A, Saiz A, רוזנפלד MR, בליס גורדון R, Graus F,
Dalmau J: טיפול גורמים פרוגנוסטיים לטווח ארוך התוצאה ב
חולים עם דלקת קולטן אנטי-NMDA קולטן: קבוצת מעקב תצפיתית
לימוד. Lancet Neurol 2013, 12:157�165.
109. Dalmau J, Gleichman AJ, יוז EG, רוסי JE, פנג X, Lai M, Dessain SK,
רוזנפלד MR, Balice-Gordon R, לינץ 'DR: קולטן אנטי-NMDA
דלקת המוח: סדרת מקרים וניתוח ההשפעות של נוגדנים.
Lancet Neurol 2008, 7:1091�1098.
110. גראוס F, Boronat A, Xifro X, Boix M, Svigelj V, Garcia A, Palomino A, Sabater
L, Alberch J, Saiz A: הפרופיל הקליני המתרחב של קולטן אנטי AMPA
דַלֶקֶת הַמוֹחַ. נוירולוגיה 2010, 74:857�859.
111. Lai M, יוז EG, פנג X, ג 'ואו L, Gleichman AJ, Shu H, Mata S, Kremens
D, ויטאליאני R, Geschwind MD, Bataller L, Kalb RG, דייוויס R, גראוס F, לינץ 'DR,
Balice-Gordon R, Dalmau J: נוגדנים לקולטן AMPA בלימבית
דלקת המוח משנה את מיקום הקולטן הסינפטי. אן נוירול 2009, 65:424�434.
112. נג'אר S, פרלמן D, דווינסקי O, נג'אר א, נדקרני S, באטלר ט, זגזג D:
נוירופסיכיאטרי אוטואימוניות דלקת המוח עם VGKC שלילי שלילי,
NMDAR, ו- GAD נוגדנים עצמיים: דו"ח מקרה וסקירת ספרות,
הקרוב. התנהגות ניורול. בעיתונות.
113. נג'אר ס ', פרלמן ד', זגזג ד ', דוינסקי O: פתרון ספונטני
דלקת ריאות אוטואימונית אוטואימונית. Cogn Behav Neurol 2011,
24: 99 105.
114. Gabilondo I, Saiz A, גלאן L, גונזלס V, Jadraque R, סאברטר L, Sans A,
Sempere A, Vela A, Villalobos F, Vi�als M, Villoslada P, Graus F: ניתוח של
הישנות באנטי-NMDAR אנצפליטיס. נוירולוגיה 2011, 77:996–999.
115. בארי H, Hardiman O, Healy DG, Keogan M, Moroney J, Molnar PP, Cotter
DR, מרפי KC: אנטי-NDA קולטן דלקת המוח: חשוב
אבחנה מבדלת בפסיכוזה. Br J Psychiatry 2011, 199:508�509.
116. דיקרסון F, דוכנים C, Vaughan C, אוריגוני A, Khushalani S, Yolken R:
נוגדנים לקולטן הגלוטמט במניה. הפרעה דו קוטבית 2012,
14: 547 553.
117. O'Loughlin K, Ruge P, McCauley M: אנצפליטיס וסכיזופרניה: a
עניין של מילים. בר J פסיכיאטריה 2012, 201: 74.
118. פאראט KL, אלן M, לואיס SJ, Dalmau J, Halmagyi GM, מרגלים JM: חריפה
מחלה פסיכיאטרית באישה צעירה: צורה יוצאת דופן של דלקת המוח.
Med J Aust 2009, 191:284�286.
119. סוזוקי Y, Kurita T, Sakurai K, Takeda Y, Koyama T: מקרה מקרה של אנטי NMDA
דלקת קרום המוח חשוד בסכיזופרניה. Seishin Shinkeigaku
Zasshi 2009, 111:1479�1484.
120. Tsutsui K, Kanbayashi T, Tanaka K, Boku S, Ito W, Tokunaga J, Mori A,
הישיקאווה Y, Shimizu T, Nishino S: נוגדן אנטי-NMDA קולטן זוהה
ב דלקת המוח, סכיזופרניה, ונרקולפסיה עם תכונות פסיכוטיות.
BMC פסיכיאטריה 2012, 12: 37.
121. ואן Putten WK, Hachimi-Idrissi S, Jansen A, ואן גורפ V, Huyghens L:
סיבה נדירה להתנהגות פסיכוטית בילדה בת 9: מקרה
להגיש תלונה. דווח על מקרה MD 2012, 2012: 358520.
122. Masdeu JC, Gonzalez-Pinto A, Matute C, Ruiz De Azua S, Palomino A, De
ליאון ג ', ברמן KF, דלמאו ג: סרום נוגדן IgG נגד NR1
יחידת משנה של הקולטן NMDA לא זוהה סכיזופרניה. Am J
פסיכיאטריה 2012, 169:1120�1121.
123. Kirvan CA, סווידו SE, Kurahara D, Cunningham MW: חיקוי סטרפטוקוקלי
ו נוגדנים בתיווך איתות איתות הפתוגנזה של
הכוריאה של סידןהם. אוטואימוניות 2006, 39:21�29.
124. סווגו SE: זיהום סטרפטוקוקאלי, תסמונת טורט ו- OCD: האם יש
קשר? פנדות: סוס או זברה? נוירולוגיה 2010, 74:1397�1398.
125. Morer A, Lazaro L, Sabater L, Massana J, קסטרו J, גראוס F: Antineuronal
נוגדנים בקבוצת ילדים עם הפרעה אובססיבית-כפייתית
ותסמונת טורט. J Psychiatr Res 2008, 42:64-68.
126. Pavone P, ביאנקיני R, Parano E, Incorpora G, Rizzo R, Mazzone L, Trifiletti RR:
נוגדנים נוגדי מוח ב PANDAS לעומת סטרפטוקוקל מסובך
הַדבָּקָה. Pediatr Neurol 2004, 30:107�110.
127. מינה G, אלברט U, Bogetto F, Borghese C, Berro AC, Mutani R, רוסי F,
ויגליאני MC: נוגדנים נוגדי מוח בחולים מבוגרים עם אובססיבי קומפולסיבי
הפרעה. J Affect Disord 2009, 116:192�200.
128. ברימברג L, Benhar I, Mascaro-Blanco A, אלווארז K, D לוטן, חורף C, קליין J,
משה AE, Somnier FE, לקמן JF, סווידו SE, Cunningham MW, יואל D:
הפרעות התנהגותיות, פרמקולוגיות ואימונולוגיות לאחר
חשיפה סטרפטוקוקלית: מודל עכברוש רומן של סידנהם chorea ו
הפרעות נוירופסיכיאטריות הקשורות. Neuropsychopharmacology 2012,
37: 2076 2087.
129. דייל RC, Candler PM, כנסיית AJ, המתן R, Pocock JM, Giovannoni G:
אנזימים glycolytic פני השטח נוירונים הם מטרות autoantigen ב
מחלת CNS שלאחר מחלה סטרפטוקוקלית. J Neuroimmunol 2006,
172: 187 197.
130. ניקולסון TR, פרדיננדו S, קרישניאה RB, Anhoury S, Lennox BR, MataixCols
D, קלייר א, Veale DM, Drummond LM, פיינברג NA, הכנסייה AJ,
Govannoni G, היימן אני: שכיחות של נוגדנים נגד הבסיס בזלת
הפרעה אובססיבית-כפייתית: מחקר חתך. בר פסיכיאטריה
2012, 200: 381 386.
131. וו K, חנה GL, רוזנברג DR, ארנולד PD: התפקיד של גלוטמט
איתות בפתוגנזה וטיפול באובססיבי-כפייתי
הפרעה. Pharmacol Biochem Behav 2012, 100:726�735.
132. פרלמוטר ג 'יי, לייטמן SF, Garvey MA, המבורגר S, פלדמן E, לאונרד
HL, Swedo SE: חילופי פלזמה טיפולית תוך ורידי
אימונוגלובולין להפרעה אובססיבית-קומפולסיבית והפרעות טיק
יַלדוּת. Lancet 1999, 354:1153�1158.
133. Pereira A Jr, Furlan FA: אסטרוציטים וקוגניציה אנושית: דוגמנות
אינטגרציה מידע ו אפנון של הפעילות העצבית.
פרוג נוירוביול 2010, 92:405-420.
134. Barres BA: המסתורין ואת הקסם של גליה: פרספקטיבה על התפקידים שלהם ב
בריאות ומחלות. Neuron 2008, 60:430 �440.
135. Verkhratsky A, פרפורה V, רודריגז JJ: איפה המחשבות לשכון:
פיזיולוגיה של העצבית- glial "מפוזר רשת עצבית". Brain Res Rev 2011,
66: 133 151.
136. Sofroniew MV: דיסקציה מולקולרית של אסטרוגליוזה תגובתי צלקת גליה
היווצרות. Trends Neurosci 2009, 32:638�647.
137. המילטון NB, Attwell D: האם astrocytes באמת exocytose נוירוטרנסמיטרים?
Nat Rev Neurosci 2010, 11:227�238.
138. Rajkowska G: מחקרים שלאחר המוות בהפרעות במצב הרוח מצביעים על שינוי
מספר נוירונים ותאי גליה. Biol Psychiatry 2000, 48:766-777.
139. קפלנד NJ, Ogilvie CJ, הגאדורן KM, סירס P, Hanstock CC, Allen נ.ב .:
ירידה של מיו-אינוסיטול בפרה-פרונטלית בהפרעה דיכאונית גדולה.
ביול פסיכיאטריה 2005, 57:1526�1534.
140. מיגל-הידלגו ג'יי ג'יי, Overholser JC, Jurjus GJ, מלצר היי, דיטר L, Konick L,
Stockmeier CA, Rajkowska G: immunoreactivity כלי הדם ואת כלי הדם
עבור מולקולה הדבקה בין תאית 1 בקורטקס אורביטופרונטלי של
נבדקים עם דיכאון גדול: שינויים תלויי גיל. להשפיע על הפרעה
2011, 132: 422 431.
141. מיגל-הידלגו ג'יי ג'יי, וויי ג'יי אר, אנדרו מ ', אוברולסר ג'יי סי, יורגיוס ג', סטוקמאייר
CA, Rajkowska G: פתולוגיה Glia בקליפה הפריפרונטאלית באלכוהול
תלות עם וללא תסמיני דיכאון. Biol פסיכיאטריה 2002,
52: 1121 1133.
142. Stockmeier CA, Mahajan GJ, Konick LC, Overholser JC, Jurjus GJ, מלצר היי,
Uylings HB, פרידמן L, Rajkowska G: שינויים נייד שלאחר המוות
היפוקמפוס בדיכאון מג'ורי. Biol Psychiatry 2004, 56:640�650.
143. Ong�r D, Drevets WC, Price JL: הפחתת גליה בפרה-פרונטלית התת-גנואלית
קורטקס בהפרעות מצב רוח. Proc Natl Acad Sci USA 1998, 95:13290�13295.
144. גיטינים RA, הריסון PJ: מחקר morphometric של גליה נוירונים ב
הקדמי cingulate קורטקס ב מצב הרוח הפרעת. J להשפיע על הפרעת 2011,
133: 328 332.
145. Cotter D, מקאי D, Beasley C, קרווין R, Everall אני: צפיפות גלייה מופחתת
ואת נפח עצבי בהפרעה דיכאונית גדולה סכיזופרניה ב
הקורטקס הקדמי הקדמי [אבסטרקט]. סכיזופרניה Res 2000, 41: 106.
146. Si X, מיגל, Hidalgo JJ, Rajkowska G: ביטוי GFAP מצטמצם ב
קליפת המוח הקדם-סרטנית בדיסטולטרל בדיכאון. בחברה למען מדעי המוח; 2003.
Neuroscience פגישה Planne: ניו אורלינס; 2003.
147. Legutko B, Mahajan G, Stockmeier CA, Rajkowska G: אסטרוציטים החומר הלבן
מופחתים בדיכאון. בחברה לחקר המוח. מפגש מדעי המוח
מתכנן: וושינגטון, DC; 2011.148. אדגר N, Sibille E: תפקיד פונקציונלי putative עבור oligodendrocytes ב
מצב רוח. תרגם לפסיכיאטריה 2012, 2: e109.
149. Rajkowska G, Halaris A, Selemon LD: הפחתת נוירונים וגליאלי
צפיפות המאפיינים את הקורטקס הפריפרונטאלי dorsolateral ב דו קוטבית
הפרעה. Biol Psychiatry 2001, 49:741-752.
150. Cotter D, מקיי D, חנה G, Beasley C, לנדאו S, Everall IP: מופחת
גודל נוירונים וצפיפות תא גליה באזור 9 של dorsolateral
קליפת המוח הקדם-פרונטלית בחולים עם הפרעת דיכאון מרכזית. Cereb קורטקס
2002, 12: 386 394.
151. סטארק AK, Uylings HB, Sanz-Arigita E, פקנברג B: אובדן תא גליה ב
הקורטקס הקדמי הקדמי, אזור תת-קליפה של הקורטקס הפריפרונטאלי
נבדקים עם סכיזופרניה. Am J Psychiatry 2004, 161:882-888.
152. Konopaske GT, דורף פטרסן KA, מתוק RA, פירי JN, ג 'אנג W, סמפסון
אר, לואיס DA: השפעת חשיפה אנטי פסיכוטית כרונית על אסטרוציט ו
מספרים oligodendrocyte בקופים מקק. Biol פסיכיאטריה 2008,
63: 759 765.
153. סלמון LD, לידו MS, Goldman-Rakic PS: נפח מוגבר וגליאלי
צפיפות בקליפת המוח הפריפרונטלית הקדומה הקשורה בכרוניקה
חשיפה לתרופות אנטי פסיכוטיות. Biol Psychiatry 1999, 46:161-172.
154. שטיינר י, ברנשטיין HG, Bielau H, Farkas N, חורף J, Dobrowolny H, Brisch R,
Gos T, Mawrin C, Myint AM, Bogerts B: S100B- גלובל החיידק הוא
מוגבה פרנואידית לעומת סכיזופרניה שיורית: א
מחקר מורפומטרי. J Psychiatr Res 2008, 42:868-876.
155. קרטר CJ: eIF2B ו הישרדות oligodendrocyte: איפה הטבע ולטפח
נפגשים בהפרעה דו קוטבית וסכיזופרניה? Schizophr בול 2007,
33: 1343 1353.
156. הייאשי Y, Nihonmatsu-Kikuchi N, Hisanaga S, יו XJ, Tatebayashi Y:
דמיון נוירופתולוגי והבדלים בין סכיזופרניה
ו הפרעה דו קוטבית: זרימת המוח cytometric שלאחר המוות המוח.
פלוס אחד 2012, 7: e33019.
157. Uranova NA, Vikhreva OV, רחמנובה השישי, Orlovskaya DD: Ultrastructural
שינויים של סיבים myelinated ו oligodendrocytes ב prefrontal
קורטקס בסכיזופרניה: מחקר מורפומטרי שלאחר המוות.
טיפול במכון Schizophr 2011, 2011: 325789.
158. Torres-Platas SG, Hercher C, Davoli MA, Maussion G, Labonte B, Turecki
G, Mechawar N: hyperrorophy Astrocytic ב cingulate הקדמי לבן
עניין של התאבדויות מדוכאות. Neuropsychopharmacology 2011,
36: 2650 2658.
159. פריירה ג 'וניור, Furlan FA: על התפקיד של סינכרון עבור נוירון-אסטרוציט
אינטראקציות ועיבוד מודעות תפיסתי. J Biol Phys 2009,
35: 465 480.
160. Kettenmann H, Hanisch בריטניה, נודה M, Verkhratsky א: פיזיולוגיה של
מיקרוגליה. Physiol Rev 2011, 91:461�553.
161. Tremblay ME, סטיבנס B, סיירה A, Wake H, Bessis A, Nimmerjahn A: התפקיד
של מיקרוגליה במוח הבריא. J Neurosci 2011, 31:16064�16069.
162. Kaindl AM, Degos V, Peineau S, Gouadon E, Chhor V, לורון G, Le
צ'רפנטייה T, Josserand J, עלי C, ויויאן D, Collingridge GL, Lombet A, עיסא L,
רנה F, Loeffler JP, Kavelaars A, Verney C, Mantz J, Gressens P: הפעלה של
מיקרוגליאל N-methyl-D קולטנים aspartate מעורר דלקת ו
מוות של תאים עצביים במוח המתפתח והמוח. אן ניורול
2012, 72: 536 549.
163. שוורץ ז, שקד אני, פישר י, מזרחי ט, שורי: מגן
אוטואימוניות נגד האויב בתוך: לחימה גלוטמט רעילות.
Trends Neurosci 2003, 26:297�302.
164. Pacheco R, Gallart T, לואיס C, פרנקו R: תפקיד של גלוטמט על תא T
חסינות מתווכת. J Neuroimmunol 2007, 185:9–19.
165. נג'אר ס ', פרלמן ד', מילר, דווינסקי O: אפילפסיה עקשנית קשורה
עם הפעלה מיקרוגליאלית. נוירולוג 2011, 17:249�254.
166. שוורץ M, Butovsky O, ברוק W, Hanisch בריטניה: פנוטיפ microglial: הוא
מחויבות הפיכה? Trends Neurosci 2006, 29:68�74.
167. וואנג F, וו H, שו S, גואו X, יאנג J, X שן: הגירה מקרופאג
גורם מעכב מפעיל cyclooxygenase 2-prostaglandin E2 בתרבית
מיקרוגליה בעמוד השדרה. Neurosci Res 2011, 71:210�218.
168. ג'אנג XY, Xiu MH, שיר C, Chenda C, וו GY, Haile CN, Kosten ת"א, Kosten
TR: גדל S100B בסרום אף פעם לא תרופתי ותרופות
חולים סכיזופרניים. J Psychiatr Res 2010, 44:1236-1240.
169. Kawasaki Y, ג 'אנג L, צ' נג ג 'יי, ג' י RR: מנגנוני ציטוקינים של מרכז
רגישות: תפקיד מובהק וחופף של אינטרליוקין- 1beta,
interleukin-6, וגידול נמק גורם אלפא ב ויסות סינפטי ו
פעילות נוירונים בחוט השדרה השטחי. J Neurosci 2008,
28: 5189 5194.
170. M�ller N, Schwarz MJ: הבסיס האימונולוגי של גלוטמטרגיה
הפרעה בסכיזופרניה: לכיוון תצוגה משולבת. J עצב
Transm Suppl 2007, 72:269�280.
171. Hestad KA, Tonseth S, Stoen CD, Ueland T, Aukrust P: רמות פלסמה גבוהות
של אלפא נמק גורם גידולים בחולים עם דיכאון: נורמליזציה
במהלך טיפול בנזעי חשמל. J ECT 2003, 19:183-188.
172. Kubera M, Kenis G, Bosmans E, Zieba A, Dudek D, Nowak G, Maes M:
פלזמה רמות interleukin- 6, interleukin- 10, ו interleukin- קולטן 1
אנטגוניסט בדיכאון: השוואה בין המצב החריף ואחריו
הֲפוּגָה. Pol J Pharmacol 2000, 52:237�241.
173. מילר BJ, Buckley P, Seabolt W, Mellor A, Kirkpatrick B: Meta-Analysis of
שינויים ציטוקינים בסכיזופרניה: מצב קליני ותרופות אנטי פסיכוטיות
אפקטים. Biol Psychiatry 2011, 70:663-671.
174. פוטווין S, סטיפ E, Sepehry AA, Gendron A, Bah R, Kouassi E: דלקתית
שינויים ציטוקינים בסכיזופרניה: סקירה כמותית שיטתית.
ביול פסיכיאטריה 2008, 63:801�808.
175. Reale M, Patruno A, דה לוטיס MA, Pesce M, Flaco M, Di Giannantonio M, Di
ניקולה M, גרילי A: dysregulation של ייצור כימותרפיה ציטוקין ב
חולי סכיזופרניה לעומת בקרות בריאות. BMC Neurosci 2011, 12: 13.
176. Fluitman SB, Denys DA, Heijnen CJ, Westenberg HG: סלידה משפיעה על TNFalpha,
רמות IL-6 ו- Noradrenalin בחולים עם אובססיבי-קומפולסיבי
הפרעה. Psychoneuroendocrinology 2010, 35:906-911.
177. Konuk N, Tekin IO, Ozturk U, Atik L, Atasoy N, Bektas S, ארדואן A: פלזמה
רמות של נמק הגידול- alpha ו- interleukin-6 באובססיביות
הפרעה אובססיבית. מתווכים דלקת 2007, 2007: 65704.
178. מונטליאונה P, Catapano F, Fabrazzo M, Tortorella A, מאג 'M: ירידה
רמות דם של גורם נמק בגידול נגיפי אלפא בחולים עם אובססיבי קומפולסיבי
הפרעה. נוירופסיכוביולוגיה 1998, 37:182-185.
179. Marazziti D, Presta S, Pfanner C, Gemignani A, רוסי A, Sbrana S, Rocchi V,
Ambrogi F, Cassano GB: שינויים אימונולוגיים ב אובססיבי קומפולסיבי
הפרעה. Biol Psychiatry 1999, 46:810-814.
180. זאי G, ארנולד PD, בורוז E, ריכטר MA, קנדי JL: נמק הגידול
פקטור אלפא לא קשור בהפרעה אובססיבית-קומפולסיבית.
ג 'נט 2006, 16: 43.
181. Rodr�guez AD, Gonzlez PA, Garc�a MJ, de la Rosa A, Vargas M, Marrero F:
וריאציות שיגרתיות בריכוז ציטוקינים פרו-דלקתיים בחריפות
אוטם שריר הלב. Rev Esp Cardiol 2003, 56:555�560.
182. אוליבר JC, Bland LA, Oettinger CW, Arduino MJ, מקאליסטר SK, Aguero SM,
Favero MS: קינטיקה ציטוקינים במודל במבחנה כל הדם הבא
אתגר אנדוטוקסין. Lymphokine Cytokine Res 1993, 12:115�120.
183. Le T, Leung L, קרול WL, Schibler KR: רגולציה של interleukin-10 הגן
הביטוי: מנגנונים אפשריים האחראים על upregulation שלה ועל
הבדלים maturational בביטוי שלה על ידי תאי דם mononuclear.
Blood 1997, 89:4112�4119.
184. Lee MC, Ting KK, אדמס S, Brew BJ, צ'אנג R, Guillemin GJ:
אפיון הביטוי של קולטני NMDA בבני אדם
אסטרוציטים. פלוס אחד 2010, 5: e14123.
185. Myint AM, קים YK, Verkerk R, Scharpe S, Steinbusch H, לאונרד B:
מסלול Kynurenine בדיכאון מרכזי: ראיות לקוי
הגנה עצבית. J Affect Disord 2007, 98:143�151.
186. Sanacora G, Treccani G, Popoli M: לקראת השערת גלוטמט של
דיכאון: גבול מתפתח של נוירופסיכופארמקולוגיה עבור
הפרעות במצב הרוח. Neuropharmacology 2012, 62:63�77.
187. סאלח א, Schroeter M, Jonkmanns C, Hartung HP, Modder U, Jander S: ב
vivo MRI של דלקת במוח שבץ איסכמי אנושי. המוח 2004,
127: 1670 1677.
188. Tilleux S, Hermans E: Neuroinflammation ואת הרגולציה של glutamate Glial
קליטה בהפרעות נוירולוגיות. J Neurosci Res 2007, 85:2059�2070.
189. הלמס HC, Madelung R, Waagepetersen HS, Nielsen CU, ברודין B: במבחנה
ראיות עבור הגלוטמט המוח השערה ההשערה: המוח האנדותל
תאים cocultured עם astrocytes להציג מקוטב למוח לדם
הובלה של גלוטמט. 2012, 60:882�893.
190. לאונרד BE: הרעיון של דיכאון כמו תפקוד לקוי של החיסון
מערכת. Curr Immunol Rev 2010, 6:205�212.
191. Labrie V, וונג AH, רודר JC: תרומות של מסלול D-serine ל
סכִיזוֹפרֶנִיָה. Neuropharmacology 2012, 62:1484�1503.
192. גרא G, Samah B, הוברט א, לאונה C, Porcheray F, Rimaniol AC: EAAT
ביטוי על ידי macrophages ו microglia: עדיין יותר שאלות מאשר
תשובות. חומצות אמינו 2012, 42:221�229.
193. ליווינגסטון PD, דיקינסון JA, Srinivasan J, Kew JN, Wonnacott S:
גלוטמט- dopamine crosstalk ב קליפת המוח prefrontal חולדה מאופיינת על ידי קולטני Alpha7 ניקוטין ו potentiated ידי PNU-120596. J מול
Neurosci 2010, 40:172–176.194. Kondziella D, Brenner E, Eyjolfsson EM, Sonnewald U: How do glialneuronal
אינטראקציות התואמות את השערות הנוירוטרנסמיטר הנוכחי של
סכִיזוֹפרֶנִיָה? Neurochem Int 2007, 50:291�301.
195. וו HQ, Pereira EF, ברונו JP, Pellicciari R, אלבוקרקי EX, שוורץ R:
אסטרוציט נגזר alpha7 קולטן ניקוטין אנטגוניסט kynurenic חומצה
שולט רמות גלוטמט תאיים בקליפת המוח הפריפרונטאלית. J מול
Neurosci 2010, 40:204�210.
196. שטיינר J, Bogerts B, Schroeter ML, ברנשטיין HG: חלבון S100B ב
הפרעות נוירודגנרטיביות. Clin Chem Lab Med 2011, 49:409�424.
197. Steiner J, Marquardt N, Pauls I, Schiltz K, Rahmoune H, Bahn S, Bogerts B,
שמידט רי, ג 'ייקובס R: אדם CD8 (+) תאים T ותאי NK להביע ו
מפריש S100B עם גירוי. Brain Behav Immun 2011, 25:1233�1241.
198. שנמוגאם נ, קים YS, Lanting L, Natarajan R: תקנה של
cyclooxygenase-2 הביטוי במונוציטים על ידי קשירת הקולטן
למוצרי קצה מתקדמים של גליקציה. J Biol Chem 2003, 278:34834�34844.
199. Rothermundt M, Ohrmann P, אבל S, זיגמונד א, פדרסן א, פונאת G,
סוזלו ט, פיטרס מ ', קסטנר פ, היינדל W, ארולט V, Pfleiderer B: תא גליה
הפעלת תת קבוצה של חולים עם סכיזופרניה שצוינו על ידי
גדל ריכוז בסרום S100B ו מיאו-inositol מוגבה.
Prog Neuropsychopharmacol Biol Psychiatry 2007, 31:361-364.
200. Falcone T, Fazio V, לי C, סיימון B, פרנקו K, Marchi N, Janigro D: Serum
S100B: סמן ביולוגי פוטנציאלי להתאבדויות בקרב מתבגרים? PLoS ONE
2010, 5: e11089.
201. Schroeter ML, עבדול חאליק H, קרבס M, Diefenbacher A, Blasig IE: Serum
סמנים תומכים במחלות גלייה ספציפיות למחלה בדיכאון מרכזי.
J Affect Disord 2008, 111:271�280.
202. Rothermundt M, Ahn Jn, יורגנס S: S100B בסכיזופרניה: עדכון.
Gen Physiol Biophys 2009, 28 מפרט ללא מיקוד:F76�F81.
203. Schroeter ML, עבדול חאליק H, קרבס M, Diefenbacher A, Blasig IE: Neuronspecific
enolase הוא ללא שינוי ואילו S100B הוא מורם בסרום של
חולים עם סכיזופרניה מחקר ומטה-אנליזה מקוריים.
Psychiatry Res 2009, 167:66�72.
204. Rothermundt M, Missler U, Arolt V, פיטרס M, Leadbeater J, Wiesmann M,
רודולף S, Wandinger KP, קירשנר H: מוגברת S100B רמות הדם ב
מטופלים סכיזופרניים בלתי מטופלים ומטופלים קשורים בקורלציה
סימפטומטולוגיה שלילית. מול פסיכיאטריה 2001, 6:445�449.
205. Suchankova P, Klang J, Cavanna C, Holm G, Nilsson S, ג 'ונסון EG, Ekman A:
האם פולימורפיזם Gly82Ser בגן RAGE רלוונטי
סכיזופרניה ותכונת האישיות פסיכוטיזם? פסיכיאטריה Neurosci
2012, 37: 122 128.
206. Scapagnini G, Davinelli S, דראגו F, דה לורנצו A, אוריאני G: נוגדי חמצון כמו
תרופות נוגדות דיכאון: עובדה או בדיה? CNS Drugs 2012, 26:477�490.
207. Ng F, Berk M, דין O, בוש AI: מתח חמצוני בהפרעות פסיכיאטריות:
בסיס ראיות והשלכות טיפוליות. אינטל J נוירופסיכופארמקול
2008, 11: 851 876.
208. סלים S, Chugh G, Asghar M: דלקת בדאגה. עסקי חלבון כימית
Struct Biol 2012, 88:1�25.
209. אנדרסון G, Berk M, Dodd S, Bechter K, Altamura AC, Dell'osso B, Kanba S,
Monji A, Fatemi SH, Buckley P, Debnath M, Das UN, Meyer U, M�ller N,
Kanchanatawan B, Maes M: אימונו דלקתי, חמצון ניטרוטיבי
מתח, ו neuroprogressive נתיבים באטיולוגיה, כמובן וטיפול
של סכיזופרניה. Prog Neuropsychopharmacol Biol Psychiatry 2013, 42:1�42.
210. Coughlin JM, Ishizuka K, קאנו SI, אדוארדס JA, Seifuddin FT, Shimano MA,
Daley EL, et al: ירידה מסומנת של superoxide superutide dissutase-1
(SOD1) בנוזל שדרתי של חולים עם הופעת המחלה
סכִיזוֹפרֶנִיָה. מול פסיכיאטריה 2012, 18:10�11.
211. Bombaci M, Grifantini R, Mora M, Reguzzi V, פטרקה R, Meoni E, Balloni S,
Zingaretti C, Falugi F, Manetti AG, מרגריט אני, Musser JM, Cardona F, Orefici
G, גרנדי G, Bensi G: חלבון מערך פרופילים של סיק החולה טיק מגלה א
טווח רחב ותגובה חיסונית משופרת נגד קבוצה א '
אנטיגנים סטרפטוקוקוס. פלוס אחד 2009, 4: e6332.
212. ולריו א, קרדילה א, קוזי V, Bracale R, Tedesco L, Pisconti A, Palomba L,
Cantoni O, קלמנטי E, Moncada S, Carruba MO, Nisoli E: TNF-alpha
downregulates הביטוי eNOS וביוגנזה המיטוכונדריה בשומן
ושרירים של מכרסמים שמנים. J Clin Invest 2006, 116:2791�2798.
213. אוט M, Gogvadze V, Orrenius S, ז'יוטובסקי B: מיטוכונדריה, חמצון
מתח ומוות תאים. אפופטוזיס 2007, 12:913-922.
214. שלו ה', סרלין י, פרידמן א': פריצת מחסום הדם-מוח כשער
להפרעה פסיכיאטרית. Neurol 2009, 2009: 278531.
215. אבוט ניו ג 'רזי, Ronnback L, הנסון E: אינטראקציות אנדוליות אנדותל ב
מחסום דם מוח. Nat Rev Neurosci 2006, 7:41�53.
216. בכטר ק, ריבר ח ', הרצוג, פוקס ד', טומאני ח ', מקסיינר ג:
ניתוח נוזל שדרתי בספקטרום רגשי וסכיזופרני
הפרעות: זיהוי תת-קבוצות עם תגובות חיסוניות
תפקוד לקוי של מחסום דם-CSF. J Psychiatr Res 2010, 44:321�330.
217. האריס LW, Wayland M, לאן M, רייאן M, Giger T, לוקסטון H, Wuethrich אני,
Mimmack M, Wang L, Kotter M, Craddock R, Bahn S: המוח
microvasculature בסכיזופרניה: לייזר ללכוד microdissection המחקר.
פלוס אחד 2008, 3: e3964.
218. לין JJ, Mula M, Hermann BP: חושפים את neurobehavioural
מחלות נלוות של אפילפסיה לאורך החיים. Lancet 2012, 380:1180�1192.
219. Isingrini E, Belzung C, Freslon JL, Machet MC, Camus V: השפעת Fluoxetine על
תחמוצת אבץ תלויה בחומצה נייטרית, בלתי צפויה
מודל מתון מתון של דיכאון בעכברים. Psychosom Med 2012,
74: 63 72.
220. ג 'אנג XY, ג' ואו DF, קאו LY, ג 'אנג PY, וו GY, שן YC: ההשפעה של
טיפול ב- risperidone על דימוטוז סופרוקסיד בסכיזופרניה. הקליניקה
Psychopharmacol 2003, 23:128-131.
221. לבוי KL, פלטייה R, ארסנו א, Dupuis J, בייקון SL: האגודה בין
דיכאון קליני ותפקוד האנדותל נמדד על ידי האמה
תגובתיות היפרמית. Psychosom Med 2010, 72:20 �26.
222. Chrapko W, Jurasz P, Radomski MW, Archer SL, ניומן SC, בייקר G, לארה N,
Le Meldo JM: שינוי של מטבוליטים פלזמה לא ירד
טסיות לא פעילות סינתזה על ידי פרוקסטין בחולים מדוכאים.
Neuropsychopharmacology 2006, 31:1286�1293.
223. Chrapko WE, Jurasz P, Radomski MW, לארה N, Archer SL, Le Meldo JM:
ירידה טסיות פעילות תחמוצת החנקן סינתזה פלזמה תחמוצת החנקן
מטבוליטים בהפרעת דיכאון מג'ורי. ביול פסיכיאטריה 2004, 56:129-134.
224. Stuehr DJ, Santolini J, Wang ZQ, Wei CC, Adak S: עדכון על מנגנון
ו תקנה קטליטי ב NO סינתזות. J Biol כימית 2004,
279: 36167 36170.
225. חן W, Druhan LJ, חן CA, Hemann C, חן YR, Berka V, Tsai AL, Zweier
JL: Peroxynitrite גורם הרס של tetrahydrobiopterin ו
heme ב תחמוצת החנקן האנדותל סינתזה: המעבר מן הפיך ל
עיכוב אנזים בלתי הפיך. ביוכימיה 2010, 49:3129�3137.
226. חן CA, וואנג TY, Varadharaj S, Reyes LA, Hemann C, Talukder MA, חן
YR, Druhan LJ, Zweier JL: S- glutathionylation unuples eNOS ו
מסדיר את תפקודו התאי וכלי הדם. טבע 2010, 468:1115�1118.
227. Szabo C, Ischiropoulos H, רדי R: Peroxynitrite: ביוכימיה,
פתופיזיולוגיה ופיתוח טיפולים. Nat Rev סמים דיסקוב
2007, 6: 662 680.
228. Papakostas GI, Shelton RC, Zajecka JM, Etemad B, Rickels K, Clain, Baer L,
דלטון אד, Sacco GR, Schoenfeld D, Pencina M, מייסנר א, Bottiglieri T,
נלסון E, מישקולון D, אלפרט JE, ברבי JG, Zisook S, Fava M: Lmethylfolate
כמו טיפול נלווה עבור SSRI עמיד דיכאון מרכזי:
תוצאות של שני ניסויים אקראיים, כפול סמיות, מקבילים ברצף. Am J
פסיכיאטריה 2012, 169:1267�1274.
229. Antoniades C, Shirodaria C, Warrick N, Cai S, דה בונו J, Lee J, Leeson P,
Neubauer S, Ratnatunga C, פילאי R, Refsum H, Channon KM: 5-
methyltetrahydrofolate משפר במהירות את תפקוד האנדותל
מקטין ייצור סופרוקסיד בכלי אדם: השפעות על כלי הדם
זמינות tetrahydrobiopterin ו תחמוצת החנקן האנדותל סינתזה
צימוד. מחזור 2006, 114:1193�1201.
230. Masano T, קוואשימה S, Toh R, Satomi-Kobayashi S, Shinohara M, Takaya T,
סאסאקי N, Takeda M, Tawa H, ימאשיטה T, יוקויאמה M, Hirata K: מועיל
ההשפעות של tetrahydrobiopterin אקסוגני על שיפוץ החדר השמאלי
לאחר אוטם שריר הלב אצל חולדות: התפקיד האפשרי של מתח חמצוני
הנגרמת על ידי תחמוצת האנדותל תחמוצת החנקן האנדותל. Circ J 2008,
72: 1512 1519.
231. אלפ NJ, Channon KM: רגולציה של תחמוצת החנקן האנדותל על ידי
tetrahydrobiopterin במחלת כלי הדם. Arterioscler Thromb Vasc Biol 2004,
24: 413 420.
232. שימאנסקי, אשטרי M, זיטו י, תואר ג ', בוגרטס ב', ליברמן י '
Gadolinium-DTPA משופר שיפוע הד הדמיה מגנטית סריקות ב
הפרק הראשון של פסיכוזה וחולים סכיזופרניים כרוניים.
Psychiatry Res 1991, 40:203�207.
233. באטלר ט, וויישולץ ד ', איסנברג נ', הרדינג א ', אפשטיין י', שטרן א ', סילברסוויג
D: הדמייה של תפקוד לקוי פרונטלי-לימבי בסכיזופרניה ו
פסיכוזה הקשורה לאפילפסיה: כלפי נוירוביולוגיה מתכנסת.
התנהגות אפילפסיה 2012, 23:113�122.234. באטלר T, Maoz A, Vallabhajosula S, Moeller J, Ichise M, Paresh K, Pervez F,
פרידמן D, גולדסמית 'S, נג'אר S, אוסבורן J, סולנס L, וואנג X,
Thesen T, Devinsky O, Kuzniecky R, שטרן E, Silbersweig D: הדמיה
דלקת בחולה עם אפילפסיה הקשורה לנוגדנים
חומצה גלוטומטית decarboxylase [אבסטרקט]. ב Amcha Epilepsy Society Abstracts,
נפח 2. בולטימור: האגודה האמריקאית לאפילפסיה; 2011: 191.
235. ואן Berckel BN, Bossong MG, בולארד R, Kloet R, Schuitemaker, Caspers
E, Luurtsema G, Windhorst לספירה, Cahn W, Lammertsma AA, Kahn RS:
הפעלת מיקרוגליה בסכיזופרניה שהתרחשה לאחרונה: כמותית (R) -
[11C] PK11195 טומוגרפיה פליטת פוזיטרונים המחקר. Biol פסיכיאטריה 2008,
64: 820 822.
236. הדלת J, דה Vries EF, Willemsen AT, דה Groot JC, Dierckx RA, קליין HC:
דלקת נוירונלית בפסיכוזה הקשורה בסכיזופרניה: מחקר PET.
J Nucl Med 2009, 50:1801-1807.
237. Takano A, Arakawa R, Ito H, Tateno A, טקהאשי H, Matsumoto R, Okubo Y,
Suhara T: קולטנים בנזודיאזפינים היקפיים בחולים עם כרוני
סכיזופרניה: מחקר PET עם [11C] DAA1106. Int J
Neuropsychopharmacol 2010, 13:943-950.
238. M�ller N, Schwarz MJ, Dehning S, Douhe A, Cerovecki A, Goldstein-Muller B,
Spellmann I, Hetzel G, Maino K, Kleindienst N, M�ller HJ, Arolt V, Riedel M:
המעכב cyclooxygenase- 2 celecoxib יש השפעות טיפוליות ב
דיכאון גדול: תוצאות של סמיות כפולה, אקראית, פלסבו
מבוקר, תוספת על פיילוט המחקר כדי reboxetine. Mol פסיכיאטריה 2006,
11: 680 684.
239. אקהונדזאדה S, Jafari S, Raisi F, Nasehi AA, Ghoreishi, Salhi B, MohebbiRasa
S, Raznahan M, Kamalipour A: ניסוי קליני של סלקוקסיב נלווה
טיפול בחולים עם דיכאון גדול: תריס כפול
ניסוי מבוקר פלצבו. חרדת דיכאון 2009, 26:607�611.
240. מנדלביץ ', קריווין P, אוסוולד P, Souery D, Alboni S, Brunello N:
הופעת קוצר של פעולה של תרופות נוגדות דיכאון בשימוש בדיכאון
Acetylsalicylic augmentation: מחקר טייס פתוח. קליניקה אינט
Psychopharmacol 2006, 21:227-231.
241. Uher R, Carver S, כוח RA, Mors O, מאייר W, ריטשל M, האוזר J,
Dernovsek MZ, Henigsberg N, Souery D, Placentino A, חקלאי A, McGuffin P:
תרופות נוגדות דלקת לא סטרואידיות ויעילות של תרופות נוגדות דיכאון
הפרעה דכאונית קשה. Psychol Med 2012, 42:2027�2035.
242. M�ller N, Riedel M, Scheppach C, Brandstatter B, Sokullu S, Krampe K,
Ulmschneider M, Engel RR, Moller HJ, Schwarz MJ: תרופות אנטי-פסיכוטיות מועילות
תופעות של טיפול סלקוקסיבי נוסף בהשוואה לריספרידון בלבד
סכִיזוֹפרֶנִיָה. Am J Psychiatry 2002, 159:1029�1034.
243. M�ller N, Riedel M, Schwarz MJ, Engel RR: השפעות קליניות של COX-2
מעכבים על קוגניציה בסכיזופרניה. Eur Arch פסיכיאטריה הקליניקה Neurosci
2005, 255: 149 151.
244. M�ller N, Krause D, Dehning S, Musil R, Schennach-Wolff R, Obermeier M,
Moller HJ, Klauss V, שוורץ MJ, Riedel M: טיפול ב- Celecoxib מוקדם
שלב של סכיזופרניה: תוצאות של אקראי, כפול סמיות, placebocontrolled
ניסוי של טיפול ב- amleulpride.
Schizophres 2010, 121:118-124.
245. Sayyah M, Boostani H, Pakseresht S, Malayeri A: ראשוני אקראי
כפול קליניים על יעילות של celecoxib כמו נספח ב
הטיפול בהפרעה אובססיבית-כפייתית. פסיכיאטריה Res 2011,
189: 403 406.
246. Sublette ME, אליס SP, ג 'יאנט אל, מאן JJ: מטה ניתוח של ההשפעות של
חומצה eicosapentaenoic (EPA) בניסויים קליניים בדיכאון. הקליניקה
פסיכיאטריה 2011, 72:1577�1584.
247. בלוך MH, Hannestad J: אומגה 3 חומצות שומן לטיפול
דיכאון: סקירה שיטתית ומטה-אנליזה. Mol פסיכיאטריה 2012,
17: 1272 1282.
248. קלר WR, קום LM, Wehring HJ, Koola MM, Buchanan RW, קלי DL: A
סקירה של חומרים אנטי דלקתיים עבור סימפטומים של סכיזופרניה.
פסיכופרמקול.
249. Warner-Schmidt JL, Vanover KE, חן EY, מרשל JJ, Greengard P:
השפעות נוגדות דיכאון של מעכבי ספיגה מחדש של סרוטונין סלקטיביים (SSRI)
נוטשים תרופות אנטי-דלקתיות בעכברים ובני אדם. Proc Natl
Acad Sci USA 2011, 108:9262�9267.
250. Gallagher PJ, קסטרו V, Fava M, ויילבורג JB, מרפי SN, Gainer VS, צ'רצ'יל
SE, Kohane IS, Iosifescu DV, Smoller JW, פרליס RH: תגובה antidepressant
בחולים עם דיכאון גדול שנחשף ל- NSAIDs: א
מחקר מעקב תרופתי. Am J Psychiatry 2012, 169:1065�1072.
251. Shelton RC: האם שימוש מקביל של NSAIDs להפחית את האפקטיביות של
תרופות נוגדות דיכאון? Am J Psychiatry 2012, 169:1012�1015.
252. מרטינז-גראס, פרז-ניבאס BG, גרסיה-בואנו ב ', מדריגל ג'.ל., אנדרס אסטבן
E, רודריגז-חימנז R, Hoenicka J, Palomo T, Rubio G, Leza JC:
אנטי דלקתיות prostaglandin 15d-PGJ2 ואת הקולטן הגרעיני שלה
PPARgamma הן ירידה בסכיזופרניה. Shizophr Res 2011,
128: 15 22.
253. Garcia-Bueno B, Perez-Nievas BG, Leza JC: האם יש תפקיד הגרעין
קולטן פרגרמה במחלות נוירופסיכיאטריות? Int J
Neuropsychopharmacol 2010, 13:1411-1429.
254. Meyer U: אנטי דלקתיות איתות סכיזופרניה. התנהגות המוח
Immun 2011, 25:1507�1518.
255. Ramer R, היינמן K, Merkord J, Rohde H, סלמון A, Linnebacher M,
HINZ B: COX-2 ו- PPAR-gamma מקנים אפופטוזיס המושרה על ידי קנבידיול
של תאי סרטן ריאות אנושיים. Mol Cancer Ther 2013, 12:69�82.
256. הנרי CJ, הואנג Y, Wynne A, האנקה M, הימלר J, ביילי MT, שרידן JF,
Godbout JP: מינוציקלין מקטין lipopolysaccharide (LPS) המושרה
neuroinflammation, התנהגות מחלה, ו anhedonia.
J 2008, 5: 15.
257. סריס J, Mischoulon D, שוויצר I: אומגה 3 עבור הפרעה דו קוטבית: metaanaleses
של שימוש במאניה ודיכאון דו קוטבי. J הקליניקה הפסיכיאטרית 2012,
73: 81 86.
258. Amminger GP, Schafer MR, Papageorgiou K, Klier CM, כותנה SM, הריגן
SM, Mackinnon A, McGorry PD, Berger GE: שרשרת ארוכה של חומצות שומן אומגה-3
עבור מניעת הצביעו על הפרעות פסיכוטיות: אקראי, placebocontrolled
ניסוי. Arch Gen Psychiatry 2010, 67:146�154.
259. Fusar-Poli P, ברגר G: התערבויות חומצה Eicosapentaenoic ב
סכיזופרניה: meta-analysis של מחקרים אקראיים, מבוקרי פלצבו.
J Clin Psychopharmacol 2012, 32:179-185.
260. Zorumski CF, פול SM, Izumi Y, Covey DF, Mennerick S: נוירוסטרואידים,
מתח ודיכאון: הזדמנויות טיפוליות פוטנציאליות.
Neurosci Biobehav Rev 2013, 37:109�122.
261. Uhde TW, Singareddy R: מחקר ביולוגי בהפרעות חרדה. ב
פסיכיאטריה כמדעי המוח. בעריכת חואן חוזה לי, וולפגנג ז, מריו ז,
Norman S. Chichester: John Wiley & Sons, Ltd; 2002:237�286.
262. גיבסון SA, Korado Z, שלטון RC: מתח חמצוני גלוטתיון
בתגובה בתרבויות רקמות מאנשים עם דיכאון גדול.
J Psychiatr Res 2012, 46:1326-1332.
263. Nery FG, Monkul ES, Hatch JP, Fonseca M, Zunta-Soares GB, Frey BN,
Bowden CL, Soares JC: Celecoxib כמו נספח בטיפול
דיכאון או מעורבים של הפרעה דו קוטבית: כפול סמיות,
מחקר אקראי מבוקר פלצבו. 2008, 23:87-94.
264. לוין J, Cholestoy A, Zimmerman J: אפקט נוגד דיכאון פוטנציאלי של
מינוציקלין. 1996, 153: 582.
265. לבקוביץ י, מנדלוביץ ', ריוקס ס, ברו י, לבקוביץ-ורבין ח', גל ז,
Fennig S, Treves I, Kron S: מחקר כפול אקראי, כפול אקראי של
מינוציקלופין לטיפול בתסמינים שליליים וקוגניטיביים
סכיזופרניה בשלב מוקדם. J Clin Psychiatry 2010, 71:138-149.
266. מיאוקה ט, יאסאקאווה ר, יאסודה ה, הישידה ז, אינאגקי ט, הוריגוצ'י י:
אפקט אנטי פסיכוטי אפשרי של מינוציקלין בחולים עם
סכִיזוֹפרֶנִיָה. Prog Neuropsychopharmacol Biol Psychiatry 2007, 31:304-307.
267. Miyaoka J, Yasukawa R, יאסודה H, Hayashida M, Inagaki T, Horiguchi J:
Minocycline כטיפול נלווה לסכיזופרניה: תווית פתוחה
לימוד. 2008, 31:287�292.
268. רודריגז CI, בנדר J ג 'וניור, מרקוס SM, Snape M, Rynn M, סימפסון HB:
מינוציקלין הגדלת הפרמקותרפיה באובססיבי-כפייתי
הפרעה: ניסוי פתוח. 2010, 71:1247�1249.
doi:10.1186/1742-2094-10-43
במאמר זה נאמר: Najjar et al .: Neuroinflammation and psychiatric
מַחֲלָה. כתב העת של Neuroinflammation 2013 10: 43.
סגור אקורדיון
המידע כאן בנושא "דלקת עצבית ומחלות פסיכיאטריות" אינו מיועד להחליף מערכת יחסים אחד על אחד עם איש מקצוע מוסמך בתחום הבריאות או רופא מורשה ואינו ייעוץ רפואי. אנו ממליצים לך לקבל החלטות בתחום הבריאות על סמך המחקר והשותפות שלך עם איש מקצוע מוסמך.
היקף המידע שלנו מוגבל לכירופרקטיקה, שרירים ושלד, תרופות פיזיות, בריאות, אטיולוגי תורם הפרעות ויסרוסומטיות במצגות קליניות, דינמיקה קלינית של רפלקס סומטויסצרלי, תסביכי תת-לוקסציה, בעיות בריאותיות רגישות ו/או מאמרים, נושאים ודיונים ברפואה תפקודית.
אנו מספקים ומציגים שיתוף פעולה קליני עם מומחים מדיסציפלינות שונות. כל מומחה נשלט על ידי היקף העיסוק המקצועי שלו וסמכות הרישיון שלו. אנו משתמשים בפרוטוקולים פונקציונליים של בריאות ובריאות כדי לטפל ולתמוך בטיפול בפציעות או הפרעות של מערכת השרירים והשלד.
הסרטונים, הפוסטים, הנושאים, הנושאים והתובנות שלנו מכסים עניינים קליניים, נושאים ונושאים הקשורים ותומכים במישרין או בעקיפין בהיקף העיסוק הקליני שלנו.*
משרדנו ניסה באופן סביר לספק ציטוטים תומכים וזיהה את המחקר או המחקרים הרלוונטיים התומכים בפוסטים שלנו. אנו מספקים עותקים של מחקרי מחקר תומכים הזמינים למועצות הרגולטוריות ולציבור על פי בקשה.
אנו מבינים כי אנו מכסים עניינים הדורשים הסבר נוסף כיצד זה עשוי לסייע בתכנית טיפול מסוימת או בפרוטוקול טיפולי; לכן, כדי לדון בהמשך בנושא לעיל, אנא אל תהסס לשאול ד"ר אלכס חימנז, די.סי, או צור איתנו קשר בכתובת 915-850-0900.
אנחנו כאן כדי לעזור לך ולמשפחתך.
ברכות
ד"ר אלכס חימנז זֶרֶם יָשָׁר, MSACP, RN*, CCST, IFMCP*, CIFM*, ATN*
דוא"ל: coach@elpasofunctionalmedicine.com
מורשה כדוקטור לכירופרקטיקה (DC) ב טקסס & ניו מקסיקו*
מס' רישיון טקסס DC TX5807, ניו מקסיקו DC # רישיון NM-DC2182
מורשה כאחות מוסמכת (RN*) in פלורידה
פלורידה רישיון RN רישיון # RN9617241 (מס' שליטה 3558029)
סטטוס קומפקטי: רישיון רב מדינות: מורשה להתאמן ב 40 מדינות*
ד"ר אלכס חימנז DC, MSACP, RN* CIFM*, IFMCP*, ATN*, CCST
כרטיס הביקור הדיגיטלי שלי